Czym jest edycja genów?
Edycja genów umożliwia wprowadzanie precyzyjnych zmian w genomie organizmów. Polega to na wprowadzaniu modyfikacji poprzez precyzyjne dodawanie, zmienianie lub usuwanie nukleotydów z sekwencji DNA. Wśród dostępnych technik, technologia CRISPR-Cas9 zyskała dużą popularność ze względu na wysoką skuteczność, dokładność i względną prostotę użycia.
Jak działa CRISPR-Cas9?
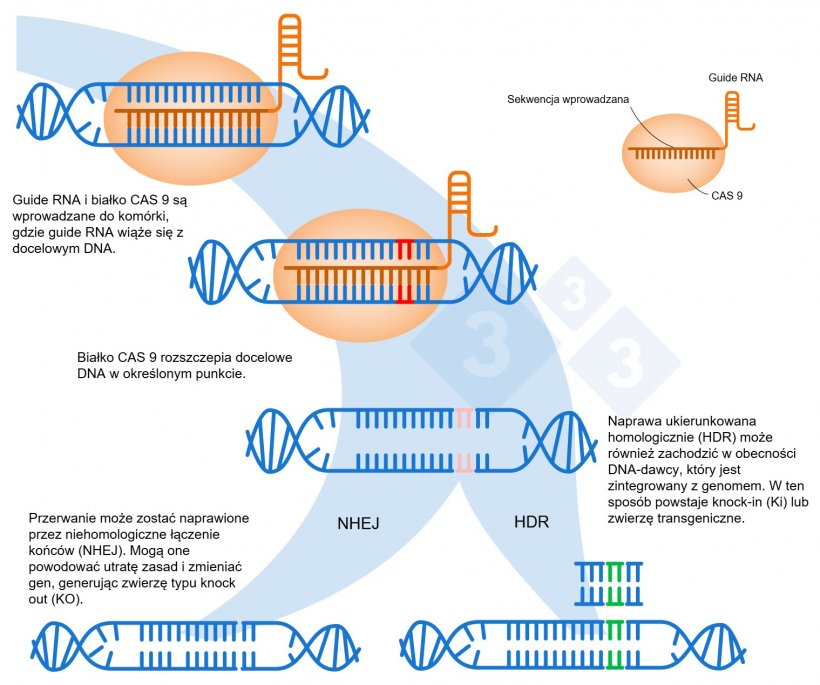
- W tym celu stosuje się gRNA (ang. guide RNA), czyli niewielką sekwencję 20 nukleotydów, która pasuje do części DNA, która ma zostać zmodyfikowana.
- gRNA kieruje enzym Cas9 do dokładnej lokalizacji, w której dwie nici DNA powinny zostać rozcięte (ryc. 1).
- Po rozszczepieniu, organizm próbuje naprawić DNA w procesie zwanym niehomologicznym łączeniem końców (ang. non-homologous end joining, NHEJ). Podczas tej naprawy niektóre pary zasad mogą zostać dodane lub utracone w miejscu rozszczepienia.
- Te zmiany w DNA mogą zmienić ramkę odczytu genu, prowadząc do zmian w sekwencji aminokwasów białka wytwarzanego przez gen. W rezultacie białko może stać się wadliwe lub niefunkcjonalne. (Ryc. 2).
|
Pamiętaj, że białka składają się z długich łańcuchów aminokwasów, które są podstawowymi jednostkami białek. Istnieje 20 różnych rodzajów aminokwasów, z których każdy jest kodowany przez określoną sekwencję trzech zasad azotowych w DNA, zwanych trójkami lub kodonami. Tymi zasadami mogą być adenina, cytozyna, tymina lub guanina.  Gdy ramka odczytu DNA (tj. sposób, w jaki zasady są pogrupowane w trójki) ulega zmianie, zmienia się również sekwencja kodonów. Może to skutkować włączeniem nieprawidłowych aminokwasów podczas syntezy białek, a nawet spowodować wystąpienie kodonu stop, który przerywa syntezę białek (ryc. 2). |

Zwierzęta typu knock-out: gdy zmiany w DNA unieczynniają białko
Zwierzę jest uznawane za knock-out (KO) dla określonego genu, gdy zmiany genetyczne wyłączają funkcję białka. Zmiany te są podobne do mutacji, które mogą wystąpić naturalnie w wyniku spontanicznych procesów, ale w tym przypadku są one dokonywane w kontrolowany i ukierunkowany sposób. Dlatego niemożliwe jest rozróżnienie, czy mutacja u zwierzęcia wystąpiła naturalnie, czy została wywołana w laboratorium.
| Należy zauważyć, że w tym procesie NIE jest wprowadzany materiał genetyczny innych gatunków, więc zwierzęta KO stworzone tą techniką nie są uważane za transgeniczne. |
Przykładem zwierzęcia KO jest zwierzę odporne na wirusa PRRS. Aby PRRSV mógł zainfekować świnię, musi związać się ze specyficznym receptorem obecnym w makrofagach pęcherzykowych płuc świni. Receptor ten jest kodowany przez domenę SRCR5 genu CD163. Jeśli receptor ten zostanie zmodyfikowany lub usunięty poprzez edycję genów, wirus nie może już wiązać się z komórkami, zapobiegając infekcji i czyniąc świnię całkowicie odporną na PRRSV. Ta genetyczna odporność może być dziedziczona przez potomstwo, zapewniając, że przyszłe pokolenia będą odporne na PRRS.
Zwierzęta knock-in: wprowadzanie nowych nici DNA i nowych genów
Alternatywą w edycji genów jest wykorzystanie momentu rozszczepienia DNA przez Cas9 w celu wprowadzenia nowej nici DNA. W ten sposób komórka może włączyć nowy materiał genetyczny w procesie zwanym naprawą ukierunkowaną homologicznie (ang. homology-directed repair, HDR. Ryc. 1). Pozwala to na zastąpienie wadliwej sekwencji DNA funkcjonalną, korygując gen, aby znów był funkcjonalny lub zmieniając ramkę odczytu w celu stworzenia zwierzęcia KO, w którym gen został dezaktywowany. Ponadto technika ta umożliwia wprowadzenie do genomu organizmu nowego dodatkowego genu, którego wcześniej nie posiadał, znanego jako knock-in (KI) lub transgeniczny.
| Gdy wprowadzony gen pochodzi od innego gatunku, powstaje kombinacja genetyczna, która nie występuje naturalnie. Ten typ organizmu nazywany jest zwierzęciem transgenicznym, ponieważ posiada geny pochodzące od innego gatunku zintegrowane z jego DNA. |
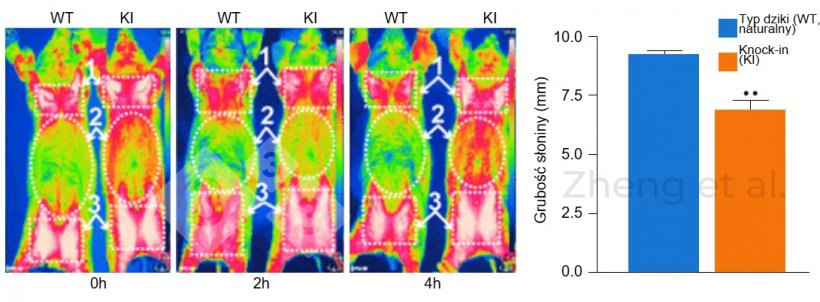
Przykładem transgenicznych świń są te, do których wprowadzono gen UPC1, który nie występuje naturalnie u tego gatunku. Gen ten pozwala im lepiej regulować temperaturę ciała, co czyni je lepiej przystosowanymi do wytrzymywania niskich temperatur. W rezultacie świnie gromadzą mniej tłuszczu podskórnego, aby utrzymać temperaturę ciała, co zwiększa procent tkanki beztłuszczowej (ryc. 3).
Edytory zasad: precyzyjne narzędzie do edycji genów
Nowszą alternatywą w edycji genów jest wykorzystanie edytorów zasad, które są wyspecjalizowanymi enzymami, które zamiast rozcinać DNA, precyzyjnie wymieniają parę zasad w określonym miejscu w genomie. Proces ten umożliwia wprowadzanie ukierunkowanych zmian w DNA bez tworzenia przerwań.
Ten rodzaj substytucji może mieć kilka skutków. W niektórych przypadkach zmiana wprowadza kodon stop, który przedwcześnie zatrzymuje produkcję białka, pozostawiając je niekompletne i prawdopodobnie niefunkcjonalne. W innych przypadkach substytucja zmienia aminokwas w białku (znana jako mutacja missense), co może modyfikować jego strukturę i wpływać na jego funkcję. W obu przypadkach zmiany te mogą zagrozić funkcjonalności białka.

Czy wszystkie świnie poddane edycji genetycznej są takie same? Regulacja Normatywna a Rozwój Techniczny
Ważne jest, aby mieć techniczną wiedzę na temat różnych rodzajów edycji genów, ponieważ przepisy, które mają lub powinny mieć zastosowanie, różnią się w poszczególnych przypadkach. Obecnie większość światowych przepisów ściśle ogranicza wykorzystanie zwierząt transgenicznych i komercjalizację pochodzących od nich produktów. Poczyniono jednak postępy w rozróżnianiu zwierząt modyfikowanych genetycznie i zwierząt transgenicznych, co może prowadzić do zróżnicowania przepisów. Z technicznego punktu widzenia te dwa rodzaje modyfikacji genetycznych są całkowicie różne.
Przepisy w Unii Europejskiej dotyczące genetycznie zmodyfikowanych produktów roślinnych, znanych jako nowe techniki genomowe (NGT), są już poddawane przeglądowi. Mogłoby to pozwolić na wyłączenie tych roślin spod przepisów regulujących transgenikę zwaną organizmami modyfikowanymi genetycznie (GMO). Jednak do tej pory zwierzęta edytowane genetycznie nadal podlegają przepisom dotyczącym GMO, co ogranicza możliwości ich rozwoju i przyszłej komercjalizacji.

Projekt finansowany przez Fundación Seneca 22065/PI/22.


