Wirus grypy typu A (influenza A virus – IAV) jest czynnikiem etiologicznym ważnej choroby układu oddechowego świń występującej na całym świecie. Ze względu na komplikującą się ekologię zakażeń IAV u świń, na skutek reasortacji i mutacji wirusa, pojawiły się nowe możliwości wykrywania wirusa i rozpoznawania choroby.
Obecnie dostępne są metody bezpośredniego wykrywania bieżącej infekcji wirusem grypy jak i pośrednie umożliwiające potwierdzanie wcześniejszego kontaktu z drobnoustrojem. Pobieranie próbek w celu bezpośredniej identyfikacji powinno uwzględniać okres replikacji wirusa i siewstwa, które mają miejsce 1-8 dniu po zakażeniu. Przeciwciała swoiste mogą być wykrywane od 7-21 dnia po zakażeniu, i najlepiej jeśli ich poziom może być porównywany w odstępie 2-4 tygodni. Próbki diagnostyczne, bez względu na rodzaj, powinny być schładzane po pobraniu do 4°C i przesyłane do laboratorium z pakietami mrożeniowymi w ciągu 48 godzin (Ryc. 1).

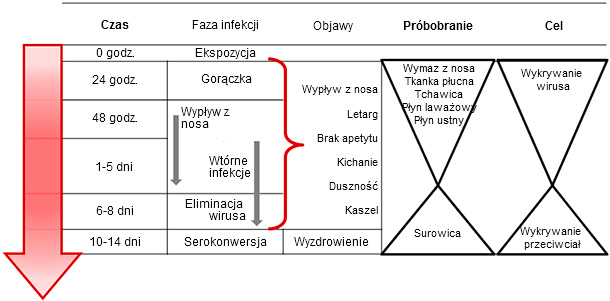
Ryc.1. Schemat pobierania próbek w celu bezpośredniego i pośredniego wykrywania i diagnostyki zakażeń IAV u świń. Pobieranie próbek w celu wykrycia wirusa powinno mieć miejsce w okresie siewstwa w początkowej fazie infekcji. Wykrywanie przeciwciał może mieć miejsce w późniejszym okresie po zakażeniu.
Testy PCR są powszechnie wykorzystywane jako narzędzie wykrywanie IAV w wielu laboratoriach, w próbkach przyżyciowych jak i pośmiertnych, takich jak płyn ustny, wydzielina z nosa czy tkanka płucna. Testy PCR są szybkie, czułe i specyficzne ponieważ opierają się na wykrywaniu materiału genetycznego IAV, RNA. Ponadto PCR może być wykorzystywany do typowania szczepów wirusa, i określania czy zakażenie jest wywołane przez szczepy H1N1, H1N2 czy H3N2. Wyniki PCR z próbek pobieranych przyżyciowo powinny być interpretowane z ostrożnością ponieważ wyniki dodatnie mogą być uzyskiwane również od klinicznie zdrowych zwierząt. Przy badaniach w kierunku IAV w danej populacji wykorzystuje się również sekwencjonowanie niektórych genów wirusa, jak hemaglutyniny, a także izolację wirusa.
Badanie immunohistochemiczne (IHC) również może być wykorzystywane w rozpoznawaniu zakażeń świń wirusem grypy ale jego zastosowanie ogranicza się do tkanek utrwalonych w formalinie. W wyniku reakcji chemicznej dochodzi do wybarwienia antygenu IAV co można obserwować pod mikroskopem. Zaletą IHC jest możliwość obserwacji antygenu wirusa w obrębie zmian chorobowych w płucach. Na czułość i specyficzność testu wpływaj dobór próbek oraz proces utrwalania w formalinie.
W diagnostyce przyżyciowej IAV u świń wykorzystywane są również takie próbki jak płyn ustny i wydzielina z nosa. Płyn ustny stał się popularnym materiałem do badań diagnostycznych ze względu na łatwość pobierania oraz zdolność do reprezentowania dużej populacji. Płyn ustny pobiera się wieszając w kojcu bawełniany sznur na 20-30 minut. Należy dążyć do ograniczenia zanieczyszczenia paszą, kałem czy innym materiałem organicznym. Wydzielina z nosa jest pobierana przy użyciu patyczka zakończonego syntetycznym materiałem chłonnym i transportowana w podłożu płynnym odpowiednim dla materiału wirusowego, zabezpieczającym przed wysychaniem.
Płyn ustny może być trudny do pobrania od prosiąt noworodków. Bardzo łatwo jest go natomiast uzyskać od warchlaków, tuczników i dorosłych świń. Wadą płynu ustnego jest zawartość inhibitorów reakcji PCR a niewielka zawartość wirusa może utrudniać sekwencjonowanie lub izolację szczepów. Wymazy z nosa zwykle są łatwiejszym materiałem do sekwencjonowania i izolacji wirusa grypy ze względu na większą ilość drobnoustroju ale z drugiej strony wymaga to pobierania próbek od większej liczby świń w ostrej fazie zakażenia.
Rozpoznawanie klinicznej postaci zakażenia IAV u świń wymaga badania sekcyjnego analizy próbek płuc utrwalonych w formalinie oraz świeżych a także próbek tchawicy lub płynu laważowego. Tkanka płucna świń chorych na grypę jest zwykle ciemno-czerwona, z ogniskami stwardnienia w doczaszkowo brzusznych partiach płuc. Patolodzy zauważą objawy martwicy nabłonka w drogach oddechowych (oskrzela i oskrzeliki) zajętych płuc. Rozpoznanie klinicznej postaci zakażenia wirusem grypy jest możliwe na podstawie korelacji objawów klinicznych, zmian sekcyjnych i mikroskopowych, oraz wyniku badania laboratoryjnego takiego jak PCR czy IHC (Ryc. 2).
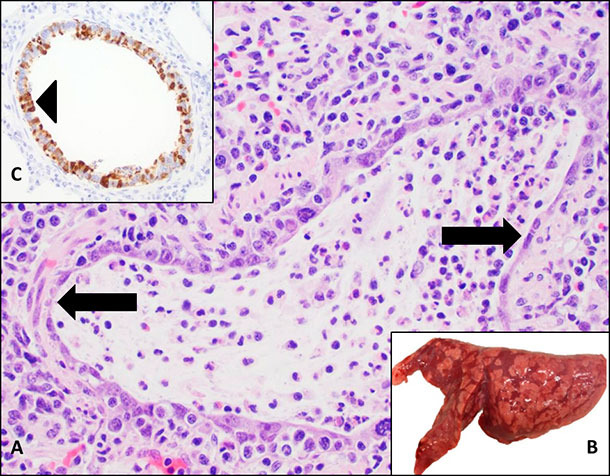
Ryc. 2. Wirus grypy jest ważnym czynnikiem chorób układu oddechowego świń. A. Zmiany mikrospokopowe wywołane zakażeniem IAV z martwicą nabłonka oskrzelików (strzałka) gdzie miało miejsce namnażanie się wirusa. B. Zmiany sekcyjne charakteryzują się obszarami stwardnienia tkanki płucnej o zabarwieniu ciemnoczerwonym. C. IAV może być wykryty metodą immunohistochemii (IHC). Brązowe zabarwienie jest widoczne w martwiczo zmienionym nabłonku oddechowym (strzałka).

W surowicy można przyżyciowo wykrywać obecność przeciwciał dla IAV. ELISA typu bloking do wykrywania przeciwciał dla konserwatywnej nukleoproteiny jest często wykorzystywana do potwierdzania kontaktu z wirusem, szczepienia, lub w przypadku prosiąt i warchlaków, do wykrywania przeciwciał siarowych. Test hamowania hemaglutynacji (HI) lub test seroneutralizacji wirusa (SVN), może pomóc w przewidywaniu odporności krzyżowej. Stosowanie szczepionek przeciw grypie oraz rozpowszechnienie zakażeń enzootycznych ogranicza użyteczność technik serologicznych w diagnostyce. Należy pamiętać aby wyniki badań serologicznych interpretować w kontekście stada i jego historii.
Rozpoznając zakażenia IAV lub grypę należy właściwie formułować pytania na jakie ma odpowiedzieć badanie i zastosować odpowiednie testy diagnostyczne. Od właściwie przeprowadzonego próbobrania i postępowania z próbkami będzie zależało jakie korzyści uzyskamy z diagnostyki IAV u świń.



