Dostępne testy:
Warto zapoznać się ze świetnym podsumowaniem zawartym w artykule Phila Gaugera na temat grypy:


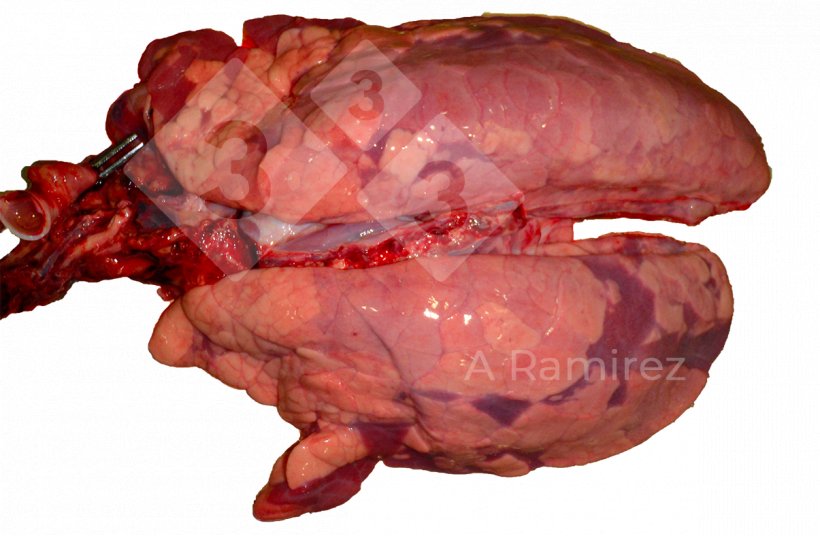
Ocena zmian makroskopowych:
- Ocenia obecność zmian w tkankach, które mogą sugerować obecność choroby.
- Lokalizacja zmian:
- Konsolidacja dogłowowo-brzuszna (zwłaszcza płat szczytowy i sercowy)

-
Objawy mogą być rozproszone, obejmując wiele obszarów płuc
-
Może występować obrzęk międzypłatowy
- Zalety:
- Nasilenie zmian może mieć związek ze znaczeniem klinicznym
- Wady:
-
Zmiany makroskopowe nie są diagnostyczne (bardzo podobne do towarzyszących zakażeniu Mycoplasma hyopneumoniae)
-
Często występują wtórne lub współistniejące infekcje
-
Histopatologia
-
Ocenia obecność zmian, które mogą potwierdzić obecność choroby.
-
Rodzaje próbek: tkanka płucna
- Zalety:
- Martwicze zapalenie oskrzelików jest zwykle uważane za patognomoniczne dla zakażenia wirusem grypy typu A u świń

Rycina 3: Badanie histopatologiczne płuc wykazujące ścieńczenie nabłonka oskrzelików, co jest przykładem martwicy (źródło zdjęcia: Phil Gauger ISUVDL). - Charakterystyczne zmiany pojawiają się kilka dni po wyeliminowaniu wirusa z organizmu świni, zwłaszcza w przypadku współwystępowania zakażeń.
- Martwicze zapalenie oskrzelików jest zwykle uważane za patognomoniczne dla zakażenia wirusem grypy typu A u świń
- Wady:
- Ocena tylko małej próbki tkanki
- Niepowikłane zmiany mogą szybko ustąpić (5-7 dni)
Immunohistochemia (IHC)
-
Wykrywa obecność antygenu wirusowego
-
Typy próbek: tkanka płucna

- Zalety:
- Wykrywa wirusa w miejscu uszkodzenia (dobry dowód na związek przyczynowy)
- Docelowym antygenem jest często nukleoproteina wirusa grypy typu A, która nie ma tendencji do dużej zmienności.
- Wady:
- Ocena tylko małej próbki tkanki
- Wirus jest obecny tylko przez krótki okres czasu (kilka dni)
- Wymaga obecności znacznie większej ilości wirusa niż PCR
Izolacja wirusa
- Izoluje żywego wirusa
- Rodzaje próbek: tkanka płucna, popłuczyny oskrzelowo-pęcherzykowe, wymazy z nosa
- Zalety:
- Tradycyjny złoty standard
- Izolacja wirusa do wykorzystania w opracowywaniu szczepionek (szczepionki autogenne) lub testach serologicznych (hamowanie hemaglutynacji) w celu określenia ochrony krzyżowej.
- Wady:
- Drogie
- Długie oczekiwanie na wynik
- Wymaga zarodków kurzych jaj lub komórek Madin-Darby canine kidney (MDCK)
- Proces inokulacji jest bardzo pracochłonny
- Często trudny do wyhodowania (wiele wyników fałszywie ujemnych)
- Sposób pobierania próbek z terenu do laboratorium może wpływać na przetrwanie wirusa
Reakcja łańcuchowa polimerazy (PCR)
- Wykrywa obecność określonej sekwencji wirusowego kwasu nukleinowego (RNA)
- Rodzaje próbek: wymazy z nosa, płyny ustne, tkanka płucna, popłuczyny oskrzelowo-pęcherzykowe
- Zalety:
- Startery mogą być zaprojektowane do:
-
Wykrywania wszystkich podtypów wirusa grypy A - docelowa mało zmienna nukleoproteina
-
Wykrywanie określonych grup podtypów wirusa: podtyp H1, H3, N1 lub N2
-
- Wysoka czułość
- Wczesne wykrywanie
- Kwantyfikacja PCR może być powiązana z obecnością zmian chorobowych
- Umiarkowany koszt
- Startery mogą być zaprojektowane do:
- Często można łączyć wymazy lub próbki tkanek, aby obniżyć koszty, jednocześnie minimalizując utratę czułości (szczególnie w odniesieniu do znaczenia klinicznego).
- Wady:
- Wysoka czułość - szczególnie w płynach ustnych może wykryć obecność niewielkich ilości wirusa w stadzie, co sprawia, że kliniczna interpretacja wyników jest trudna w odniesieniu do zakresu lub ciężkości choroby.
- Wirus jest obecny w organizmie gospodarza tylko przez kilka dni (3-5 dni, zwłaszcza w wymazach z nosa).
- Nie można użyć próbek krwi lub surowicy do testów PCR, ponieważ wirus pozostaje w drogach oddechowych i nie ma charakteru ogólnoustrojowego.
Sekwencjonowanie genomu
- Sekwencjonuje segmenty genetycznego kwasu nukleinowego (RNA) wirusa
- Rodzaje próbek: tkanki płuc, wymazy z nosa, popłuczyny oskrzelowo-pęcherzykowe, płyny ustne
- Zalety:
- Można różnicować podtypy na wiele różnych poziomów kladów.
- H1: dalej podzielony na klady zwykle nazywane przy użyciu alfabetu greckiego (alfa, beta, gamma itp.)
- H3: dalej podzielony na gromady zwykle nazywane przy użyciu cyfr rzymskich (I, IV, itd.).
- Wiele z tych odpowiednich kladów lub klastrów zostało opisanych tutaj.
- Można różnicować podtypy na wiele różnych poziomów kladów.
- Może pomóc w odróżnieniu nowo wprowadzonego wirusa od istniejących lub przeszłych wirusów.
- Może pomóc w wyborze szczepu szczepionki w oparciu o podtyp/klad
- Wady:
- Kosztowne
- Zazwyczaj tylko sekwencja genu HA
- Zmienność między podtypami/kladami nadal rośnie i staje się bardzo złożona.
Test immunoenzymatyczny (ELISA)
- Wykrywa obecność przeciwciał
- Rodzaje próbek: surowica
- Zalety:
- ELISA może być zaprojektowana tak, aby:
- Wykrywać przeciwciała różnych podtypów - ukierunkowane na konserwatywną nukleoproteinę
- Wykrywać przeciwciała specyficzne dla podtypu - docelowe specyficzne białka hemaglutyniny (określane jako H lub HA) i/lub neuraminidazy (określane jako N lub NA)
- ELISA może być zaprojektowana tak, aby:
- Zwierzęta pozostają dodatnie przez kilka tygodni (wynik zaczyna spadać po 8-10 tygodniach)
- Może być stosowana w przypadkach przewlekłych
- Wady:
- Wykrywane specyficzne przeciwciała i czas wykrycia różnią się nieznacznie w zależności od dostępnych zestawów komercyjnych.
- Serododatniość trwa od 10 do 14 dni.
- Nie można odróżnić przeciwciał poszczepiennych od tych po zakażeniu wirusem typu dzikiego
- Nie można zidentyfikować konkretnego podtypu wirusa
Hamowanie hemaglutynacji (HI)
- Wykrywa obecność przeciwciał
- Rodzaje próbek: surowica
- Zalety:
- Zwierzęta pozostają dodatnie przez kilka tygodni
- Może być stosowany w przypadkach przewlekłych
- Może być stosowany w celu lepszego określenia właściwego czasu szczepienia poprzez uniknięcie interferencji przeciwciał matczynych
- Może być stosowany do określenia ochrony krzyżowej między izolatami
- Wady:
- Każdy test jest swoisty dla danego szczepu
- Wymaga izolacji określonego szczepu w celu przetestowania ochrony krzyżowej
- Serododatniość trwa od 10 do 14 dni.
- Nie można odróżnić zakażenia szczepionką od zakażenia szczepem dzikim
Interpretacja wyników
Zmiany makroskopowe
- Dodatni: Potwierdzenie obecności zapalenia płuc
- Ujemny: Wczesne przypadki mogą nie objawiać się rozległymi zmianami w płucach
Histopatologia
- Dodatni: Potwierdzenie choroby
- Ujemny: Wynik ujemny lub zmiany mogły zostać przeoczone w przypadku badania niewłaściwej próbki lub zbyt późno po zakażeniu.
IHC
- Dodatni: Wirus jest obecny w miejscu zmiany
- Ujemny: Ujemny lub wirus mógł zostać przeoczony, jeśli testowanie nastąpiło zbyt późno po zakażeniu lub stężenie wirusa jest zbyt niskie (obecne tylko przez bardzo krótki okres czasu).
Izolacja wirusa
- Dodatni: Potwierdzenie choroby
- Ujemny: Ujemny, wirus mógł zostać przeoczony, jeśli testowanie nastąpiło zbyt późno po zakażeniu lub po prostu nie był w stanie się namnażać z powodu innego zanieczyszczenia lub złego obchodzenia się z próbką (obecny, ale może być trudny do wyhodowania).
PCR
- Dodatni: Potwierdzenie choroby
- Ujemny: Ujemny, wirus mógł zostać przeoczony, jeśli test został przeprowadzony zbyt późno po zakażeniu lub w przypadku niewłaściwego doboru próbki lub obchodzenia się z nią.
- Wątpliwy: Zbyt mała ilość wirusa lub koinfekcja z więcej niż jednym podtypem
Sekwencjonowanie genomu
- Umożliwia identyfikację podtypu i kladu wirusa
- Umożliwia dopasowanie izolatu szczepionki dla lepszej ochrony
ELISA
- Dodatni: Przeciwciała matczyne lub wcześniejsza ekspozycja (> 2 tygodnie) na szczepionkę lub wirus typu dzikiego
- Ujemny:
- Ujemny wobec szczepionki lub wirusa typu dzikiego
- Infekcja zbyt wczesna do wykrycia (10-14 dni do serokonwersji)
- Niedopasowanie między testem a wirusem (podtyp lub klad)
HI
- Dodatni: Przeciwciała matczyne lub wcześniejsza ekspozycja (> 2 tygodnie) na szczepionkę lub wirus typu dzikiego
- Ujemny:
- Ujemny wobec szczepionki lub wirusa typu dzikiego
- Infekcja zbyt wczesna do wykrycia (10-14 dni do serokonwersji)
- Niedopasowanie między testem a wirusem (podtyp lub klad)
Możliwe scenariusze
Rosnące świnie, które kichają i wykazują ze strony układu oddechowego (ostre lub przewlekłe):
- Pobrać 2-4 próbki płynu ustnego od grupy i przetestować metodą PCR.
- Pobrać 12 wymazów z nosa od zakażonych świń z objawami klinicznymi (z wyraźną wydzieliną z nosa) i wykonać 3 pule po 4 próbki testowane metodą PCR.
- Sekwencjonowanie jednej dodatniej próbki PCR w celu lepszego określenia klastra/kladu
Określenie czasu narażenia i ewentualnej potrzeby szczepienia:
- Pobranie próbek od 10-15 świń w wieku 3, 6, 9 i 12 tygodni.
- Dwa podejścia do pobierania próbek:
- Przekrojowe - pobieranie próbek od różnych grup wiekowych w tym samym czasie (szybsze uzyskanie wyników).
- Podłużne - zbieranie od tych samych świń w czasie (wyniki są dokładniejsze).
- Badanie próbek surowicy za pomocą testu ELISA.
- Pobranie 2-4 próbek płynu ustnego z grupy i zbadanie ich metodą PCR.
- Sekwencjonowanie jednej dodatniej próbki PCR z każdej grupy wiekowej w celu lepszego określenia klastra/kladu