Dostępne testy
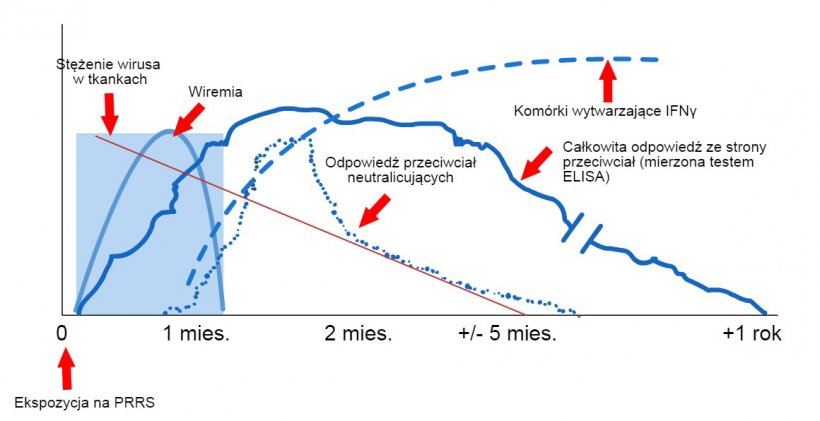
Schemat wykrywania wirusów i przeciwciał po ekspozycji na PRRS: poniższy wykres przedstawia zmiany stężenia (oś Y) w czasie (oś X) różnych analitów używanych w testach. Po ekspozycji na wirusa PRRS we krwi świń znajduje się wirus (wiremia), który często utrzymuje się od 2 do 4 tygodni, w zależności od wieku i stanu odporności świni. Serokonwersja (wykrywanie przeciwciał) zwykle występuje w okresie od 7 do 10 dni po ekspozycji i utrzymuje się przez kilka miesięcy, zanim zwierzę stanie się seronegatywna. Przeciwciała neutralizujące pojawiają się od 4 do 6 tygodni po ekspozycji (López i Osorio, 2004).

Reakcja łańcuchowa polimerazy (PCR)
- Wykrywa obecność określonej sekwencji wirusowego kwasu nukleinowego (RNA).
- Rodzaje próbek: tkanki, krew pełna, surowica, płyny ustne itp.
- Zalety:
- Oddzielne startery są używane do wykrywania PRRS typu 1 (europejski) i typu 2 (północnoamerykański) w tej samej próbce w tym samym czasie.
- Bardzo wysoka czułość (umożliwia wykrycie niewielkich ilości wirusa).
- Wczesne wykrycie - ostre przypadki powinny być pozytywne.
- Można stosować wiele różnych typów próbek (tkanka, krew, surowica, płyny ustne itp.).
- Umiarkowany koszt:
- Często umożliwia połączenie (pulowanie) 5 próbek surowicy lub tkanek w celu obniżenia kosztów przy jednoczesnej minimalizacji utraty czułości.
- Zwykle nie należy pulować płynów ustnych ze względu na spodziewane wyższe wartości Ct (niższe stężenia wirusa), co może skutkować znaczną utratą wrażliwości.
- Zalety:
- Laboratorium musi okresowo aktualizować startery, aby uniknąć fałszywie ujemnych wyników.
- Należy zaktualizować startery dla PRRS typu 1 i 2.
- Do odróżnienia wirusa szczepionkowego od infekcji wirusem terenowym potrzebne jest sekwencjonowanie.
- Laboratorium musi okresowo aktualizować startery, aby uniknąć fałszywie ujemnych wyników.
Test immunoenzymatyczny (ELISA)
- Wykrywa obecność przeciwciał.
- Typy próbek: surowica lub płyny ustne (niektóre zestawy).
- Zalety:
- Większość wykrywa przeciwciała zarówno dla PRRS typu 1, jak i typu 2.
- Zwierzęta pozostają dodatnie przez kilka miesięcy (3-12 miesięcy).
- Może być stosowany w przypadkach przewlekłych.
- Wady:
- Wykryte specyficzne przeciwciała i czas wykrycia mogą się nieznacznie różnić między różnymi dostępnymi zestawami komercyjnymi.
- Zwierzęta stają się seropozytywne po 7 do 10 dniach od zakażenia.
- Nie można odróżnić przeciwciał matczynych od pozakaźnych.
- Nie można odróżnić zakażenia szczepionką od wirusa terenowego.
Immunohistochemia (IHC)
- Wykrywa obecność antygenu wirusowego.
- Typy próbek: tkanki.
- Zalety:
- Wykrywa wirusa w miejscu zmian (dobry dowód związku przyczynowego).
- Potrafi zidentyfikować małe, średnie i duże ilości obecnego wirusa.
- Wady:
- Należy dostarczyć odpowiednią próbkę tkanki.
- Wymaga obecności znacznie większej liczby wirusów niż PCR.
- Ocena tylko małe próbki tkanki.
Sekwencjonowanie genetyczne
- Sekwencje genetyczne kwasów nukleinowych wirusa(RNA).
- Rodzaje próbek: tkanki, krew pełna, surowica, płyny ustne itp.
- Zalety:
- Pozwala odróżnić wirusa terenowego od szczepionkowego.
- Może pomóc w odróżnieniu nowych wirusów od istniejących lub historycznych szczepów wirusów.
- Wady:
- Wysoki koszt.
- Często jest sekwencjonowana tylko sekwencja ORF5, która ma 600 z ~ 15 000 par zasad.
- Próbki z wysokimi wartościami CT> 34 są zwykle trudniejsze do sekwencjonowania.
Tabela 1: Sukces sekwencjonowania w laboratorium diagnostyki weterynaryjnej Iowa State University na podstawie wartości progowych cyklu PCR (Ct) PRRS z próbek płynu ustnego. Tabela autorstwa Chrisa Rademachera i wsp. 2016.
| Próba | PCR Ct | Przebadane próbki | Liczba próbek zsekwencjonowanych | % udanego sekwencjonowania |
|---|---|---|---|---|
| Wszystkie próbki | <30 | 2016 | 2013 | 99.85 |
| 30.00-31.99 | 389 | 361 | 92.80 | |
| 32.00-33.99 | 324 | 265 | 81.79 | |
| 34.00-35.99 | 185 | 109 | 58.92 | |
| 36.00-37.00 | 65 | 26 | 40.00 |
Test pośredni przeciwciał fluorescencyjnych (IFA)
- Wykrywa obecność przeciwciał.
- Typy próbek: surowica.
- Zalety:
- Wraz z testem PCR może służyć jako test potwierdzający dla nieoczekiwanie dodatnich próbek ELISA.
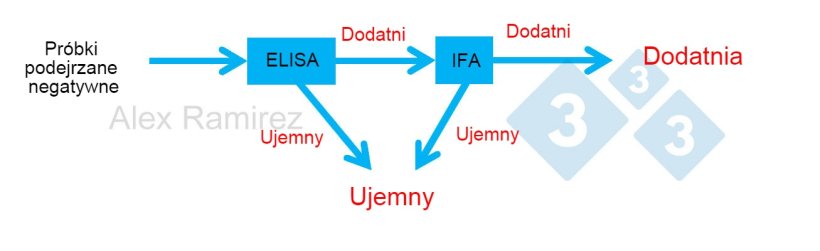
Schemat przedstawiający zastosowanie testu PRRS IFA jako testu potwierdzającego dla próbek, które nieoczekiwanie uzyskały wynik pozytywny w teście PRRS ELISA. Podejrzewana próbka negatywna, której test ELISA jest negatywna, jest uważana za negatywną. Jeśli ta próbka nieoczekiwanie dała wynik pozytywny, można przeprowadzić badanie PRRS IFA jako test potwierdzający. Oznacza to, że jeśli test IFA jest pozytywny, potwierdza się, że próbka jest pozytywna. Jeśli test IFA jest ujemny, zakładalibyśmy, że był fałszywie dodatni, o ile PCR jest również ujemny, aby potwierdzić brak niedawnej infekcji.
- Wraz z testem PCR może służyć jako test potwierdzający dla nieoczekiwanie dodatnich próbek ELISA.
- Wady:
- Niewykonalne dla dużej liczby próbek.
- Na wyniki wpływ ma izolat wirusa użyty do testu.
- Niezawodność w dużym stopniu zależy od umiejętności technika.
Interpretacja wyników
PCR
- Dodatni – wirus jest obecny / krąży na fermie, wysoce wskazując na związek przyczynowy, zwłaszcza przy niższych wartościach Ct i obecne są objawy kliniczne. Niedawne szczepienie zmodyfikowanym żywym wirusem może dać pozytywne wyniki PCR.
- Ujemny – Wynik ujemny lub wirus mógł zostać przeoczony, jeśli próbobranie nastąpiło późno po zakażeniu.
ELISA
- Dodatni – Matczyne przeciwciała lub wcześniejsza ekspozycja (zwykle> 7–10 dni po ekspozycji) na szczepionkę lub wirus terenowy.
- Ujemny – Negatywny lub infekcja nastapiła zbyt wcześnie przed próbobraniem, aby ją wykryć (zwykle musi nastąpić co najmniej 7-10 dni po ekspozycji).
IHC
- Dodatni – Wirus jest obecny w miejscu zmiany.
- Ujemny – Wynik negatywny lub wirus mógł zostać przeoczony, jeśli test nastąpił późno po zakażeniu.
Sekwencjonowanie genetyczne
- Wirus szczepionkowy– Spodziewana homologia > 99%
- Wirus terenowy –Szacunkowo około 1-2% utraty homologii na rok.
IFA
- Dodatni – Matczyne przeciwciała lub wcześniejsza ekspozycja (> 7–10 dni po ekspozycji) na szczepionkę lub wirus terenowy.
- Ujemny –Ujemny dla szczepionki lub wirusa terenowego lub bardzo wczesnej infekcji (w celu wykrycia przeciwciał musi nastąpić co najmniej 7-10 dni od ekspozycji).
Scenariusze

Ronienia loszek/ loch
Ronione płody: należy zebrać 6-8 płodów i połącz próbki do testów PCR. Tylko około 50% płodów będzie miało pozytywny wynik PCR (więc trzeba będzie pobrać próbki z wielu płodów), ale te, które są pozytywne, będą miały duże stężenie wirusa i dlatego mogą łączyć się w grupy po 10 do testów PCR.
- Lochy / loszki, które poroniły: należy pobrać surowicę od loch / loszek, które niedawno roniły (<10 dni) w celu wykonania testu PCR. Można łączyć w grupy po 5 sztuk. Test ELISA nie jest przydatny, ponieważ naiwne lochy / loszki zwykle potrzebują 7-9 dni na pozytywny wynik testu od momentu zakażenia do momentu próbobrania.
Problemy w rozrodzie loch i loszek
- Należy zebrać od 15 do 20 próbek od zakażonych i od 15 do 20 próbek od zdrowych (łącznie 30-40 próbek) loszek / loch i przetestować za pomocą PCR (pule po 5 lub 6) i ELISA (indywidualnie).
Słabo żywotne prosięta
- Można zbierać rodzinne płyny ustne ( "family oral fluids") z wielu miotów ze słabymi prosiętami i testować za pomocą PCR.
- Może zbierać jądra (jeśli jest wykonywana kastracja), ogony, tkankę języka (martwe świnie) od świń z różnych miotów w porodówce. W celu przetestowania można zebrać razem dużą liczbę próbek.
- Zebranie próbek surowicy z 10 miotów dotkniętych chorobą, pobierając od 2 do 3 prosiąt z miotu i testowanie za pomocą PCR na pulach po 5 lub 6 prosiąt w puli. Należy upewnić się, że prosięta nie zostały zaszczepione przeciwko PRRS.
Tuczniki z ostrymi objawami PRRS
- Pobieranie płynów ustnych z 4 do 6 różnych kojców i przetestować je indywidualnie za pomocą PCR. Nie należy pulować próbek płynu ustnego.
- Pobieranie od 15 do 30 próbek surowicy od świń z objawami klinicznymi lub losowo i przeprowadzenie testu za pomocą PCR. Można pulować po 5 lub 6 do testów PCR.
Tuczniki z chronicznymi objawami PRRS
- Pobieranie płynów ustnych z 4 do 6 różnych kojców i przetestować je indywidualnie za pomocą PCR. Nie należy pulować próbek płynu ustnego. Można również testować próbki płynów ustnych za pomocą testu ELISA.
- Pobieranie 30 próbek surowicy od świń z objawami klinicznymi lub losowo i przeprowadzenie testu za pomocą PCR. Można pulować po 5 lub 6 do testów PCR. Przebadanie również poszczególnych próbek za pomocą testu ELISA, aby potwierdzić fakt historycznej ekspozycji na wirusa.