Odpowiedź odpornościowa na zakażenie typem 1 (genotypem europejskim) jak i typem 2 (genotypem amerykańskim) PRRS przebiega podobnie. Zakażenie indukuje swoistą odpowiedź humoralną i komórkową, powstają przeciwciała dla całego szeregu białek wirusa, zakażenie jest zwalczane, powstaje pamięć odpornościowa, która zabezpiecza przed przyszłym, powtórnym zakażeniem. Jednak odpowiedź odpornościowa na zakażenie dwoma genotypami PRRSV różni się w niektórych aspektach. Przebieg zakażenia jak i nasilenie odpowiedzi odpornościowej są łagodniejsze w przypadku typu 1 PRRSV, niż w przypadku typu 2 PRRSV. W efekcie badania odporności na reinfekcję typem 1 PRRSV są skomplikowane ponieważ wywołanie choroby w warunkach doświadczalnych jest często trudne a zakażenie przebiega bezobjawowo. Tak więc interpretacja wyników badań może prowadzić do błędnych wniosków, ze względu na brak wyraźnych różnic między grupami kontrolnymi, dodatnią i ujemną. Z tego względu większość badań na temat odporności i wakcynologii PRRSV dotyczyła typu 2, w przypadku którego dość łatwo jest wywołać w sposób powtarzalny zarówno postać oddechową jak i rozrodczą. Te różnice i ograniczenia związane z badaniami typu 1 PRRSV są niezwykle istotne ponieważ jest on najważniejszym genotypem w Europie, podczas gdy typ 2 dominuje w Ameryce i Azji.
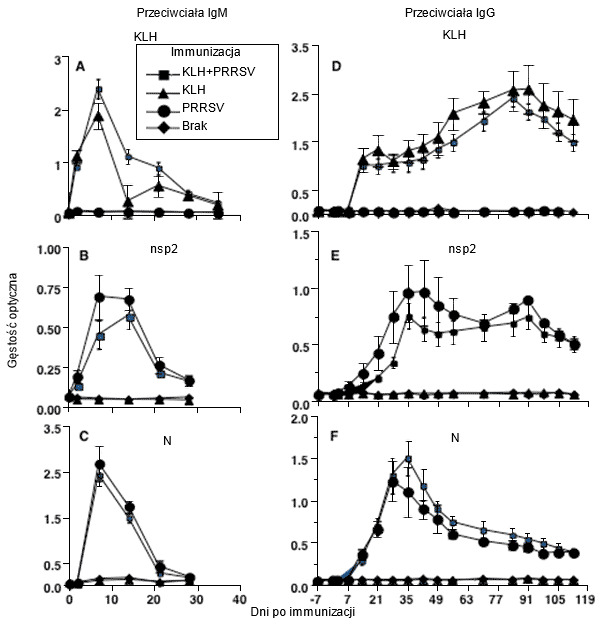

Ryc. 1. Kinetyka powstawania przeciwciał dla typu 2 PRRSV pokazuje, że odpowiedź na stymulację różnymi białkami wirusa jest taka sama jak dla zupełnie innego antygenu, hemocyjaniny (KLH) (na podstawie Mulupuri i wsp. 2008. J. Virol. 82:358-370).
Po zakażeniu PRRSV świń w pełni wrażliwych dochodzi do odpowiedzi odpornościowej nieswoistej. Zakażenie wysoce zjadliwymi PRRSV wywołuje syntezę interferonu podczas gdy po zakażeniu szczepami o niskiej zjadliwości interferon nie jest wykrywany. Kilka białek wirusa ma zdolność blokowania syntezy interferonu, lecz bez względu na efektywność odpowiedzi nieswoistej w kontroli zakażenia, obserwuje się normalną odpowiedź humoralną. Najszybciej pojawiają się przeciwciała IgM dla szeregu białek wirusa, a następnie przeciwciała IgG. Kinetyka odpowiedzi humoralnej jest identyczna jak w przypadku stymulacji jakimkolwiek antygenem. Swoiste dla PRRSV komórki plazmatyczne wydzielające przeciwciała oraz komórki pamięci B są obecne głównie w śledzionie i tkance limfoidalnej w płucach i tkankach układu rozrodczego. Migdałki są głównym organem gdzie znajdują się komórki pamięci B. Przeciwciała neutralizujące mają niskie miana i pojawiają się w późnej fazie infekcji, w czasie kiedy wiremia już jest zwalczona.
Indukcja komórek pamięci B i T jest krytyczna dla swoistej odporności na przyszłą infekcję. Swoiste dla PRRSV komórki pamięci powstają w następstwie zakażenia wirusem i są aktywne po stymulacji różnymi białkami wirusa in vitro. Jednak powtórny kontakt z wirusem uodpornionych świń nie wywołuje klasycznej odpowiedzi wtórnej (anamnestycznej). Dlatego też status odpornościowy nie może być przewidywany na podstawie odpowiedzi pozakaźnej. Efektywność uodpornienia może być określana na podstawie parametrów wirusologicznych i klinicznych, które określają redukcję objawów lub zabezpieczenie przed infekcją lub wystąpieniem objawów. Wiele badań zgodnie potwierdziło, że odporność indukowana przez żywe szczepionki lub dzikie (zjadliwe) szczepy PRRSV w istotnym stopniu zabezpiecza przed powtórnym zakażeniem odmiennymi szczepami wirusa. Epitopy antygenowe niezbędne dla pełnej odporności krzyżowej na zakażenie szczepami heterologicznymi jak dotychczas nie zostały zidentyfikowane.
Wyniki badań doświadczalnych wskazują na istnienie różnych zjawisk immunopatologicznych w przebiegu zakażenia PRRSV, takich jak hipergammaglobulinemia i zależne od przeciwciał wzmocnienie infekcji (antibody-dependent enhancement of infection, ADE), jednak brak jest wyraźnych dowodów na ich występowanie w terenie. Z drugiej strony wykazanie istnienia immunosupresji w warunkach doświadczalnych jest bardzo trudne chociaż obserwacje terenowe jasno pokazują, że ogólny stan zdrowia obniża się po wybuchu PRRS.
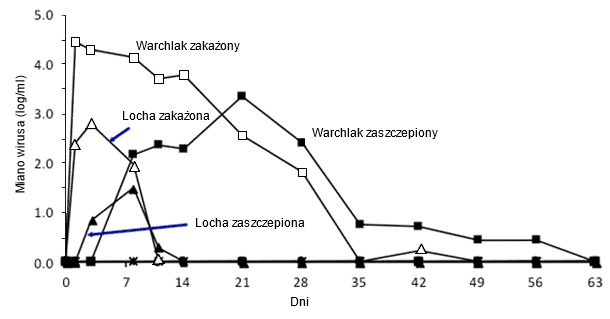
Ryc. 2. Wpływ wieku świni na wiremię PRRSV. Poziom wiremii u warchlaków i loch po podaniu zjadliwego lub atenuowanego szczepu PRRSV typ 2 (na podstawie Klinge i wsp. 2009. Virol J. 6:177-187).
Bardzo duża zmienność jest cechą charakterystyczną PRRS, zarówno jeśli chodzi o samego wirusa jak i reakcję świni na zakażenie. Typ 1 i typ 2 są genetycznie odmienne, a w obrębie każdego genotypu obserwuje się olbrzymią zmienność. Zrozumienie interakcji między PRRSV i świnią jest trudne ze względu na fakt, że większość eksperymentów wykonano z użyciem kilku izolatów wirusa, z których wiele nie jest reprezentatywnych dla obecnie krążących, i wywołujących chorobę szczepów. Podobnie, istnieje olbrzymia zmienność jeśli chodzi o przebieg zakażenia u świń w pełni wrażliwych oraz uprzednio uodpornionych. Na przykład tuczniki i lochy wykazują większą oporność na zakażenie niż warchlaki, mimo że odpowiedź odpornościowa po zakażeniu wydaje się być podobna niezależnie od wieku. Poznanie mechanizmów zmienności interakcji wirusa i świni będzie wymagało identyfikacji i charakterystyki kluczowych epitopów limfocytów T i B, wspólnych dla wszystkich szczepów PRRSV, a także molekularnych i strukturalnych cech efektorowych przeciwciał, receptorów limfocytów T i cząsteczek MHC, które pośredniczą w szerokiej odporności krzyżowej.