Obecnie najczęściej wykorzystywanymi w diagnostyce PRRSV metodami są ELISA i PCR. W tym artykule skupimy się na PCR, metodzie pozwalającej na wykrywanie wirusa w każdym materiale. Metoda PCR polega na cyklicznej polimeryzacji fragmentu DNA, lub jak w przypadku PRRSV cDNA, ograniczonego krótkimi sekwencjami, do których w każdym cyklu przyłączają się komplementarne startery DNA. Czułość i specyficzność PCR zależy od dopasowania starterów do tych fragmentów oraz od warunków termicznych i liczby cykli reakcji. Idealne startery powinny być komplementarne wyłącznie do sekwencji genomu danego gatunku wirusa, i wszystkich jego szczepów, i nie powinny łączyć się z sekwencjami innych patogenów czy DNA gospodarza. Dlatego sekwencje starterów opracowywane są na podstawie unikalnych dla danego gatunku sekwencji, jednocześnie konserwatywnych wśród szczepów należących do niego.
Wirus PRRS jest wyjątkowo trudny jeśli chodzi o możliwość opracowania wysoce czułych i specyficznych testów PCR. Obecnie znane szczepy PRRSV należą do dwóch gatunków, PRRSV-1 i PRRSV-2. Oba posiadają zasięg globalny lecz PRRSV-1 dominuje w Europie a PRRSV-2 w Ameryce i Azji. Można przyjąć, że zmienność genetyczna gatunku dominującego jest wyższa niż gatunku rzadziej spotykanego. Na skutek tego testy PCR wykorzystywane w Europie lub Ameryce są lepiej przygotowane (zwalidowane) do wykrywania odpowiednio PRRSV-1 i PRRSV-2. W konsekwencji niektóre szczepy należące do „mniej istotnego” dla danego obszaru gatunku PRRSV mogą pozostać niewykryte, a ich rola w patogenezie choroby niedoceniona. Jest to szczególnie istotne na fermach gdzie krążą szczepy obu gatunków. Ze względu na ciągłą i szybką ewolucję PRRSV, oraz odkrywanie nowych wariantów wirusa, sekwencje starterów PCR do diagnostyki choroby muszą być stale uaktualniane. Jest to szczególnie ważne dla PRRSV-1, którego zmienność jest wyjątkowo wysoka w krajach Europy Wschodniej i Rosji. Niedostateczna walidacja testów PCR z wykorzystaniem szczepów PRRSV-1 z Rosji, Białorusi czy Ukrainy może sprawiać, że niektóre z nich może charakteryzować niska czułość w wykrywaniu wschodnioeuropejskich podtypów genetycznych PRRSV-1.

Obecnie najczęściej wykorzystywanym rodzajem PCR jest PCR w czasie rzeczywistym (real time PCR). Istnieje wiele wariantów real time PCR jednak najczęściej stosowanym wariantem jest metoda wykorzystująca tak zwane sondy TaqMan. Sonda TaqMan jest krótkim fragmentem DNA znakowanym dwoma fluoroforami, który łączy się z sekwencją DNA pomiędzy miejscami wiązania starterów PCR. Jeśli do tego dojdzie, w czasie polimeryzacji DNA ma miejsce rozpad (liza) sondy i z probówki jest emitowana fluorescencja. Real time PCR pozwala na wykrywanie w jednej reakcji 2-3 różnych patogenów dzięki zastosowaniu 2-3 sond znakowanych fluoroforami emitującymi fluorescencję o różnych długościach fali. Pozwala to na jednoczesne wykrycie i różnicowanie PRRSV-1 i PRRSV-2 w próbkach od świń.
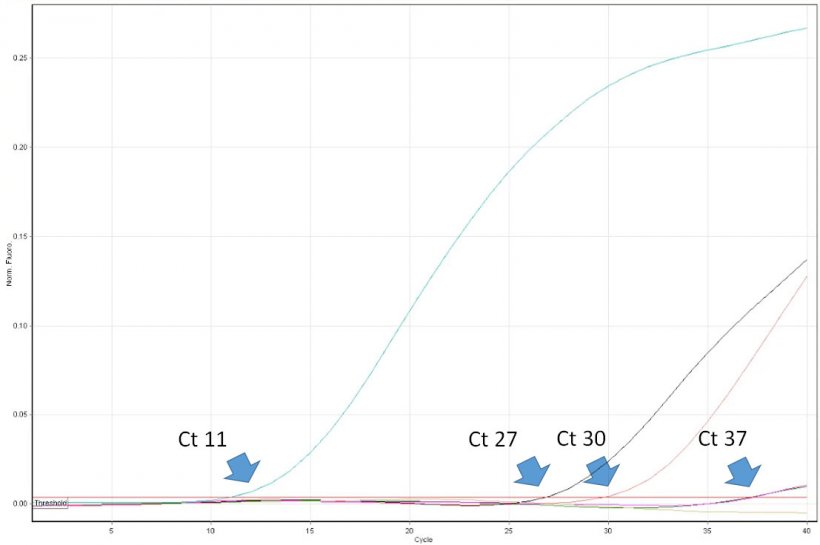
Interpretacja wyników PCR jest pozornie prosta. Lekarze weterynarii muszą być świadomi pewnych ograniczeń metody i krytycznie interpretować wyniki badań diagnostycznych z jej wykorzystaniem. Na przykład dodatni wynik PCR dowodzi obecności kwasu nukleinowego patogenu w badanej próbce lecz nie świadczy, że zawiera ona zakaźny wirus. Real time PCR pozwala na oznaczenie zawartości wirusa w próbce. Wynik reakcji jest wyrażany w wartości Ct (threshold cycle) (Ryc. 1), która oznacza kolejny numer cyklu PCR, w którym aparat wykrył emisję określonej fluorescencji z probówki reakcyjnej. Im niższa wartość Ct, tym wyższa liczba cząstek wirusa w badanej próbce. Na przykład próbkę z Ct 20 można uznać za wysoko dodatnią a próbkę z Ct 35 za słabo dodatnią. Niekiedy fluorescencja jest emitowana z próbówki w końcowych cyklach real time PCR, np. >38. Czy zawsze taki wynik można interpretować jako słabo dodatni? Niekiedy wynik taki może być rezultatem spontanicznego rozpadu sondy, co jest trudne do odróżnienia od nukleolizy w wyniku działania polimerazy DNA. Do takiego zjawiska może dochodzić więc również w przypadku braku PRRSV w próbce. Znaczenie tego niekorzystnego zjawiska jest szczególnie ważne w przypadku monitoringu populacji wolnych od PRRSV. Konieczne jest wtedy przeprowadzenie badań uzupełniających, np. przy użyciu testu ELISA. Niestety niektóre laboratoria diagnostyczne w Europie nie przedstawiają wyników real time PCR w postaci wartości Ct. Zamiast tego wynik badania jest określany jako dodani lub ujemny. Przydatność takiego sformułowania w interpretacji wyniku przez lekarza jest ograniczona i w niektórych przypadkach może prowadzić do podejmowania błędnych decyzji w odnośnie programu zwalczania PRRS.
Uwagi praktyczne
-
Żaden z obecnie dostępnych testów PCR nie jest zdolny do wykrycia wszystkich istniejących szczepów PRRSV.
-
Ujemny wynik PCR w badaniu kilku przypadkowych próbek z danej fermy nie dowodzi braku zakażenia PRRSV w obiekcie.
-
Dodatni wynik PCR dowodzi obecności kwasu nukleinowego PRRSV w badanej próbce lecz nie mówi o obecności w niej zakaźnego wirusa.








