Escherichia coli występuje naturalnie we florze jelitowej świń, jednak w pewnych okolicznościach może powodować objawy zakażenia pałeczkami okrężnicy. W zależności od warunków choroba przejawia się w różny sposób: biegunka noworodków, biegunka poodsadzeniowa, choroba obrzękowa, posocznica itd...
Postawienie właściwej diagnozy wymaga przeprowadzania dociekliwego wywiadu, wykonania prawidłowego próbobrania, pełnej diagnostyki różnicowej oraz wykorzystania różnych technik diagnostycznych. Ze względu na występowanie bezobjawowych nosicieli, wykrycie pojedynczego szczepu chorobotwórczego nie w każdym przypadku przesądza o znalezieniu przyczyny choroby. Identyfikacja poszczególnych zjadliwych szczepów i rozróżnianie ich od prawidłowej flory jelit jest bardzo aktualnym wyzwaniem diagnostycznym. Real time PCR (qPCR) zastosowano do detekcji czynników zjadliwości E.coli co uczyło go wartościowym narzędziem dostarczającym użyteczne informacje.

Bazujące na wyekstrahowanym kwasie nukleinowym pochodzącym z różnego materiału biologicznego (kał, jelita, wymazy z prostnicy lub kultury bakteryjne), testy qPCR rozpoznawały specyficzne regiony E.Coli kodujące różne czynniki zjadliwości. W tym badaniu, każda próba służyła wykryciu innego czynnika zjadliwości (patrz tabela 1). Dodatkowy qPCR (ECCO) potwierdzał obecność bakterii E. coli w badanych próbach co weryfikowało prawidłowe wykonanie testu. qPCR jest badaniem zarówno jakościowym jak i ilościowym (Rysunek 1), co daje mu przewagę nad konwencjonalnym testem PCR.
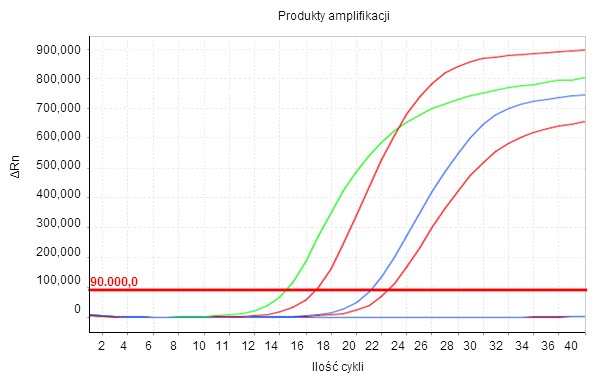
Rysunek 1. Produkt amplifikacji przedstawiono w czasie rzeczywistym wraz z rozwojem cyklów termicznych, a więc poziom fluorescencji (ΔRn) zwiększa się wykładniczo. CQ to liczba cykli, w którym fluorescencja zaczyna być widoczna. Niższa wartość Cq to wyższe początkowe stężenie badanego parametru w próbce.
Ocena zjadliwości szczepów w przypadku kolibakteriozy tradycyjne odbywa się przez namnożenie bakterii a następnie izolacje poszczególnych koloni E.coli i późniejszej charakterystyki ich czynników zjadliwości. Główną wadą tej metody jest ograniczona liczba badanych izolatów oraz to że dokładność ich rozpoznania opiera się na reprezentatywnej liczbie izolatów w badanej próbie. Co może spowodować że mniejszościowe populacje E. coli zostaną pominięte, mimo tego że są istotne klinicznie.
qPCR umożliwia analizowanie czynników zjadliwości bezpośrednio w próbce badanej. Ta metoda pozwala uniknąć etapów namnażania, hodowli i oznaczeń dla każdego z wyselekcjonowanych szczepów, co pozwala zaoszczędzić czas i pieniądze. Biorąc pod uwagę charakter ilościowy techniki, można ustalić ile kopi konkretnego genu zjadliwości jest w całej populacji E.coli w badanej próbie. W ten sposób możemy zinterpretować wyizolowane szczepy o określonej kombinacji czynników zjadliwości.
Metoda ta ma pewne ograniczenia wynikające z nieokreślonej liczy kopii poszczególnych genów kodujących dany czynnik zjadliwości w różnych populacjach bakterii. Jednak spełnia postawione zadanie: daje możliwość wykrycia E coli z konkretną kombinacja czynników zjadliwości.
Poniżej znajduje się praktyczny przykład. W przypadku podejrzenia wystąpienia choroby obrzękowej u tuczników, cztery jelita cienkie pobrane od zwierząt z objawami klinicznymi zostały wysłanie do laboratorium w celu oceny obecności werotoksycznych bakterii E. coli.
Spulowana próbka zawierająca jelita pochodzące od 4 zwierząt została poddana badaniu qPCR, z bardzo podobnymi wartościami CQ dla F18, Stx2e i ECCO (Tabela 1). Wyniki te można interpretować jako obecność znaczącej większości populacji E. coli zawierających geny kodujące dla F18 i Stx2e, tj szczepów werotoksycznych. Uzyskano również słabo dodatni wynik F4 (Cq = 36,9), co wskazywałoby na niewielką obecność populacji o tym czynniku zjadliwości
Równocześnie z prób wykonano badanie mikrobiologiczne i wyselekcjonowano 12 kolonii E.coli. Porównanie fenotypowe wykazało obecność pojedynczego szczepu (Rysunek 2). Charakterystyka tego szczepu przez oznaczenie czynników zjadliwości przez qPCR potwierdziła, że jest to potencjalny szczep werocytotoksyczny ponieważ wykryto geny kodujące dla F18 i Stx2e.
Tabela 1. Wyniki qPCR.
| Czynniki zjadliwości | Próbka 4 jelit cienkich | Wyizolowany szczep E. coli |
| F4 | POS (Cq = 36.9) | neg |
| F5 | neg | neg |
| F6 | neg | neg |
| F18 | POS (Cq = 22.28) | POS (Cq = 16.58) |
| F41 | neg | neg |
| LT | neg | neg |
| STa | neg | neg |
| STb | neg | neg |
| Stx2e | POS (Cq = 22.39) | POS (Cq = 17.29) |
| eae | neg | neg |
| ECCO | POS (Cq = 21.1) | POS (Cq = 16.97) |
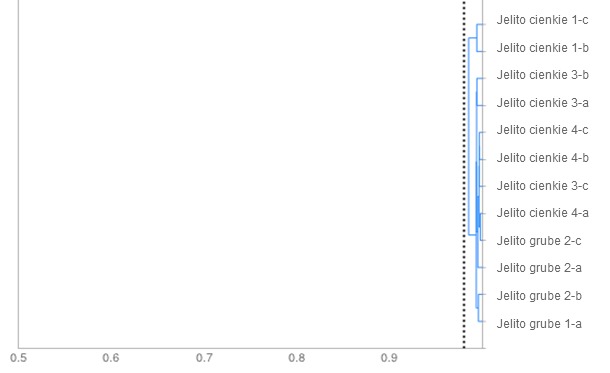

Rysunek 2. Dendrogram. Stopień podobieństwa pomiędzy szczepami E. coli, zgodnie z ich wzorem fermentacji cukru. Wszystkie izolaty które mają podobieństwo niższe niż punkt odcięcia, w wysokości 0,98 (linią przerywaną), uznaje się za szczepy wyjątkowe.
Podsumowując, zastosowanie qPCR bezpośrednio na próbkach klinicznych zapewnia znaczą oszczędność czasu i pieniędzy, jak również dostarcza istotnych informacji dla właściwego rozpoznania kolibakteriozy świń.


