Streptococcus suis (S. suis) jest endemicznym, zoonotycznym patogenem, któremu brakuje odpowiedniej profilaktyki nieantybiotykowej u świń odsadzonych. Patogeneza jest związana głównie z kolonizacją górnych dróg oddechowych i migdałków jako wejściem do układu krążenia (Segura i in., 2016), chociaż nie można wykluczyć infekcji żołądkowo-jelitowej (Swildens, 2009). Do kolonizacji dochodzi przy urodzeniu, w fazie odchowu, gdy świnie są mieszane z innymi miotami, a także podczas epidemii choroby w stadzie. Co ciekawe, są one często związane ze współistniejącymi infekcjami i czynnikami stresowymi zidentyfikowanymi jako potencjalne czynniki wyzwalające, ale naturalny proces infekcji nie jest w pełni zrozumiały i brakuje nam powtarzalnego modelu, który naśladowałby pierwsze etapy choroby. Choroba jest najczęściej rozpoznawana przez objawy neurologiczne związane z zapaleniem opon mózgowych z upośledzeniem ruchowym i często śmiertelnością.
Na podstawie modeli ludzkich i zwierzęcych wiadomo, że odpowiedź zapalna w oponach mózgowo-rdzeniowych charakteryzuje się zmniejszoną zawartością glukozy i zwiększoną zawartością mleczanu w płynie mózgowo-rdzeniowym (CSF). Stan zapalny w barierze krew-mózg (BBB) i barierze krew-płyn mózgowo-rdzeniowy (krew-CSF) zagraża funkcji mózgu, wymianie jonów i homeostazie mineralnej (Bettinelli i in., 2012). W związku z tym nie wiemy, jaki jest stan naturalnie zakażonych świń. Wiedza na ten temat mogłaby pomóc zidentyfikować czynniki podatności i zdefiniować strategie wspierające zdrowie i powrót do zdrowia.

Niniejszym celem było zbadanie różnych ognisk choroby z podejrzeniem etiologii na tle S. suis w naszym ośrodku badawczym trzody chlewnej, w tym celów cząstkowych:
- diagnozowanie ognisk choroby
- oszacowanie względnego oddziaływania choroby
- dostarczenie nowych informacji na temat patofizjologii choroby.
Nasza farma badawcza obejmuje około 160 produkcyjnych loch organizowanych w partiach co 4-5 tygodni, produkujących około 560 świń na partię, odsadzenie odbywa się w wieku około 24 dni. Badania nad paszami i zarządzaniem są prowadzone stale i jednocześnie w różnych sekcjach, w tym u loch prośnych, loch karmiących, prosiąt ssących i prosiąt po odsadzeniu (trzymanych w konwencjonalnych kojcach z n = 3-6 świniami / kojec lub elektronicznymi systemami żywienia z n = 10-12 świniami / kojec; w pełni ruszt PCV).
Gdy zaobserwowano objawy kliniczne wskazujące na chorobę paciorkowcową, pobrano próbki krwi i wymazy z migdałków od 2 świń na kojec - jednej chorej świni i drugiej losowo wybranej świni. Następnie chorym świniom podawano ampicylinę i deksametazon przez 3 dni. Przypadki obejmujące dysfunkcję ośrodkowego układu nerwowego były związane z zapaleniem opon mózgowych i definiowane jako ciężko chore (obejmowały utratę równowagi, ataksję, paraliż, opistotonię, uogólnione drżenie i wiosłowanie). Inne przypadki z objawami innymi niż neurologiczne obejmowały apatię, zaczerwienienie skóry i kulawizny, prawdopodobnie związane z posocznicą i zapaleniem stawów. Losowo wybrane świnie z kojca uznano za grupę kontrolną. Próbki krwi pobrano w ciągu 5 minut od wykrycia objawów klinicznych. Krew i surowice analizowano na obecność gazów i minerałów. Wymazy z podniebienia analizowano metodą qPCR na obecność S. suis serotypów 2 (i/lub 1/2), 7 i 9. Masa ciała została zmierzona w momencie pobierania próbek i powtórzona za 7 dni, a dane retrospektywne zostały przeszukane w naszych rejestrach hodowlanych.
Badanie obejmowało trzy główne ogniska choroby w okresie zimowym (3,8% zachorowań), wiosennym (5,3% zachorowań) i jesiennym (9% zachorowań). Każde ognisko zostało zdiagnozowane i potwierdzone na serotyp 2 (lub 1/2) S. suis poprzez obecność w tkankach za pomocą hodowli lub obecność DNA za pomocą qPCR w tkankach (zastawki serca, stawy, opony mózgowe) od świń poddanych eutanazji i padłych nagle. Jednak świnie, które były leczone i przeżyły, nie zostały zdiagnozowane laboratoryjnie. Poza tym nie od wszystkich świń, u których stwierdzono objawy kliniczne, pobrano próbki podczas tego badania, a przypadki wykryte w weekend lub bez zasobów ludzkich do odpowiedniego pobierania próbek zostały wykluczone i natychmiast poddane leczeniu.
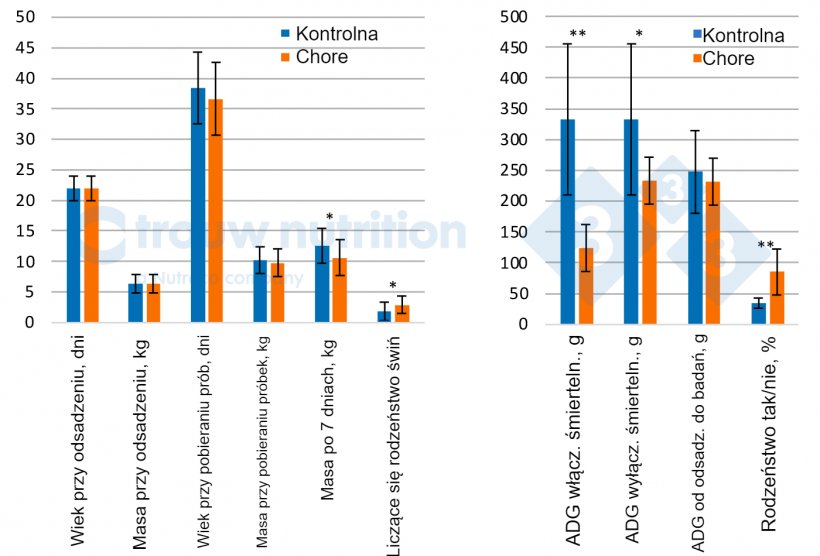
Łącznie pobrano próbki od 56 świń, w tym 28 świń podejrzanych o chorobę spowodowaną S. suis z objawami klinicznymi i 20 zdefiniowanych jako ciężko chore (objawy neurologiczne). Dane przedstawiono tylko dla świń dotkniętych chorobą neurologiczną i kontrolnych (ryc. 2 A i B).
Kontrolne kojce i chore świnie miały podobną masę ciała i wiek w momencie wykrycia objawów klinicznych i nie różniły się retrospektywnie pod względem masy ciała przy odsadzeniu lub średniego dziennego przyrostu między odsadzeniem a pobraniem próbek (P> 0.05), co sugeruje, że nie ma wyraźnego warunku wstępnego jako skrajnie słaba lub dobrze radząca sobie świnia. W ciągu 7 dni po wykryciu choroby świnie obniżyły wydajność zgodnie z prognozami (P <0,05).
Retrospektywnie zaobserwowano znaczący efekt rodzeństwa/loch z wyższym odsetkiem rodzeństwa wśród świń dotkniętych chorobą neurologiczną niż w grupie kontrolnej (P < 0,02), co jest dobrze znane i wskazuje, na znaczenie lochy jako pionowego transferu patogenu, ale może być również czynnikiem podatności. Wydajność loch nie wykazała różnic między świniami chorymi lub dotkniętymi chorobą neurologiczną a świniami kontrolnymi, co zmniejsza przewidywalność potencjalnych czynników ryzyka na podstawie wydajności loch (dane nie pokazane). Częstość występowania serotypu 2 S. suis znacząco (P<0,04) wzrosła u ciężko chorych świń (81%) w porównaniu z grupą kontrolną (44%), co jest zgodne z naszymi ustaleniami diagnostycznymi.
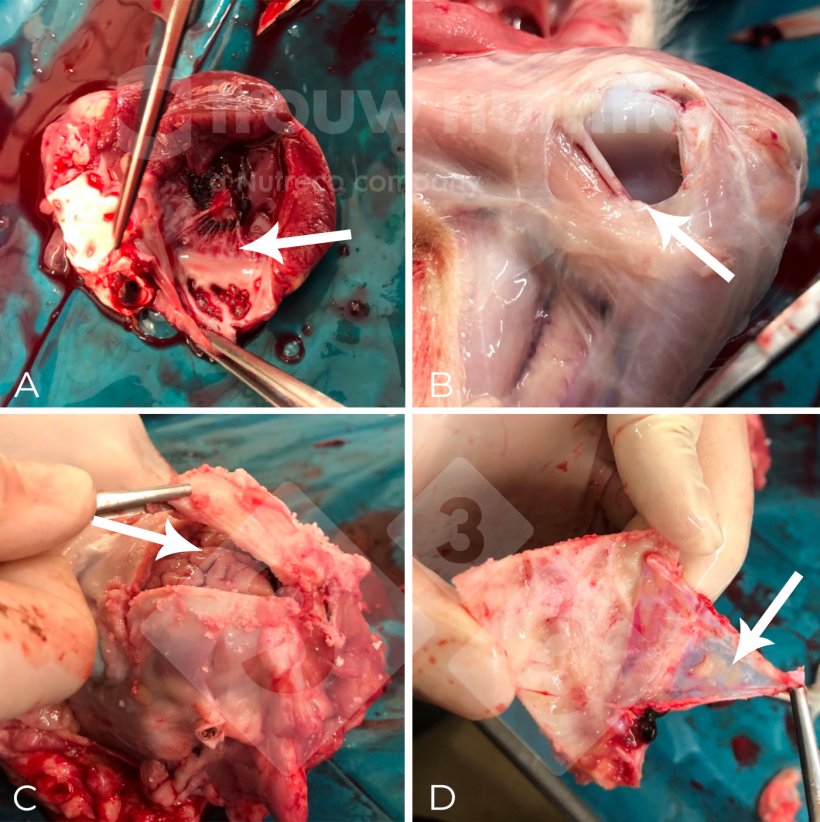
Ogólny profil patofizjologiczny zaobserwowano w parametrach krwi chorych świń z objawami neurologicznymi (Tabela 1) ze zwiększonym pH, nasyceniem O2 i występowaniem zasadowicy, ale zmniejszonym stężeniem glukozy, pCO2, iCa, Ca, P, Mg, K i Na we krwi/surowicy w porównaniu z kontrolą (P<0,05). Obserwowana zasadowica oddechowa była prawdopodobnie związana z zakwaszeniem płynu mózgowo-rdzeniowego (akumulacja mleczanu) z pleocytozy (zwiększona liczba białych krwinek w płynie mózgowo-rdzeniowym). Zapalenie opon mózgowo-rdzeniowych może powodować mózgowy zespół utraty soli, zaburzając układ współczulny, diurezę i czynność nerek, wyjaśniając utratę minerałów w tym badaniu.
Tabela 1. Główne różnice w analizie biochemicznej krwi i analizie minerałów we krwi lub surowicy chorych świń z objawami neurologicznymi (n = 20) i kontrolnych (n = 28).
| Kontrolna | Chore | Root MSE | Wartość P | |
|---|---|---|---|---|
| pH (krew) | 7.30 | 7.41 | 0.095 | <.001 |
| PCO2 (krew), mmHg | 52.5 | 41 | 9.858 | <.001 |
| PO2 (krew), mmHg | 35.5 | 39.4 | 11.69 | 0.258 |
| sO21 (krew), mmol/L | 57.1 | 67.6 | 17.16 | 0.045 |
| Nadmiar zasad (krew), mmol/L | -1.39 | 1.4 | 4.875 | 0.062 |
| Przypadki zasadowicy, % | 10.7 | 42.2 | 13.2 | 0.019 |
| Na (krew), mmol/L | 139 | 137 | 3.265 | 0.008 |
| K (krew), mmol/L | 5.21 | 4.49 | 0.791 | 0.004 |
| iCa (krew), mmol/L | 1.38 | 1.27 | 0.066 | <.0001 |
| Ca (surowica), mmol/L | 2.59 | 2.33 | 0.151 | <.0001 |
| Glukoza (krew), mg/L | 117.5 | 82.3 | 21.51 | <.0001 |
Niski poziom Na jest związany z wyższym ryzykiem nasilenia choroby i śmiertelności u dzieci z zapaleniem opon mózgowych (Chao et al., 2008), a niski poziom Ca (całkowity i zjonizowany) jest powszechny u dzieci z ciężką chorobą meningokokową. Mg współdziała z wydzielaniem parathormonu w odpowiedzi na hipokalcemię i może przyczyniać się do słabej homeostazy mineralnej w niniejszym badaniu.
Można spekulować, że interwencja mineralna i elektrolitowa, jaka obecnie jest stosowana u pacjentów z zapaleniem opon mózgowych u ludzi, może być również korzystna dla świń i potrzebne są dalsze badania w tym kierunku z wykorzystaniem kontrolowanych badań infekcji, a nie obecnego praktycznego podejścia.
Podsumowując, zapalenie opon mózgowo-rdzeniowych u naturalnie zarażonych prosiąt było związane z typową produkcją świń, bez żadnych odchyleń w wydajności przed chorobą, która podkreślałaby coś innego niż efekt lochy / miotu. Chore świnie wykazywały zasadowicę oddechową, utratę minerałów i zwiększoną częstość występowania S. suis serotyp 2 (i/lub 1/2).

Metabolic insights and background from naturally affected pigs during Streptococcus suis outbreaks. Fabà L, Aragón V, Litjens R, Galofré-Milà N, Segura M, Gottschalk M, Doelman J. Translational Animal Science, Volume 7, Issue 1, 2023, txad126.