Do oceny komórkowej odpowiedzi immunologicznej u świń stosuje się obecnie kilka zaawansowanych technik laboratoryjnych z wykorzystaniem immunologicznych komórek krwi (jednojądrzastych komórek krwi obwodowej, PBMC) lub komórek odpornościowych pochodzących z narządów obwodowych, takich jak grasica, węzły chłonne, śledziona, jelita, płuca i szpik kostny.
Techniki te zostały znacznie ulepszone w dziedzinie weterynarii i mogą być obecnie stosowane wraz z rutynowymi testami diagnostycznymi przeprowadzanymi w celu oceny humoralnej odpowiedzi immunologicznej (np. wykrywanie przeciwciał neutralizujących całkowitych i / lub w surowicy) w celu wzmocnienia mocy wyników diagnostycznych. Z wyjątkiem cytometrii przepływowej, która w ciągu ostatnich dwóch dekad była rozwijana w celu dostarczenia informacji diagnostycznych i prognostycznych w onkologii małych zwierząt, wszystkie pozostałe techniki opisane poniżej są wykorzystywane w badaniach terenowych lub doświadczalnych (kontrolowane warunki).

Jedną z najczęściej stosowanych technik jest test immunoenzymatyczny IFN-γ ELISPOT, dzięki któremu z wysoką czułością można wyliczyć liczbę komórek wydzielających IFN-γ (SC), po stymulacji komórek antygenem wirusowym (np. PRRSV, PCV2, ADV) lub antygenami mykoplazm/bakterii (np. Mycoplasma hyopneumoniae, Escherichia coli).
Jednojądrzaste komórki krwi obwodowej wyizolowane z pełnej krwi zwierząt, które weszły w kontakt z patogenem z powodu wcześniejszego szczepienia i/lub naturalnej infekcji, izolowano i testowano pod kątem ilościowej oceny limfocytów T, które ponownie aktywowano antygenem tego samego patogenu lub całym patogenem (np. całym wirusem).
Ten sposób analizy może dostarczyć istotnych informacji na temat skutecznego stanu aktywacji układu odpornościowego zwierzęcia. W rzeczywistości specyficzna dla wirusa lub bakterii indukcja pamięci i efektorowych komórek T jest wykrywana za pomocą wydzielania IFN-γ na poziomie pojedynczych komórek wizualizowanych na 96-studzienkowych płytkach.
Stosując test ELISPOT, reaktywność immunologiczną można monitorować po klasycznych lub innowacyjnych sposobach szczepienia (np. iniekcje domięśniowe vs. bezigłowe podanie śródskórne), a także po zakażeniu nowo wyodrębnionymi szczepami patogenów w celu oceny odpowiedzi zakażonych zwierząt i skuteczności nowych szczepionek pod względem ochrony i ochrony krzyżowej.
Komórkową odpowiedź immunologiczną ocenia się poprzez wyliczenie wszystkich miejsc wydzielania IFN-γ przez pojedyncze komórki i ogólnie wyraża jako liczbę SC IFN-γ w milionie testowanych komórek. Jeżeli próbka jest pozytywna, oznacza to, że zwierzę zostało wystawione na działanie antygenu wirusowego lub bakteryjnego i dzięki temu wytworzyło T-komórkową pamięć immunologiczną, która może zapewnić pewien stopień ochrony po kolejnym narażeniu na ten sam patogen i /lub krzyżową ochronę innych wariantów patogenu.
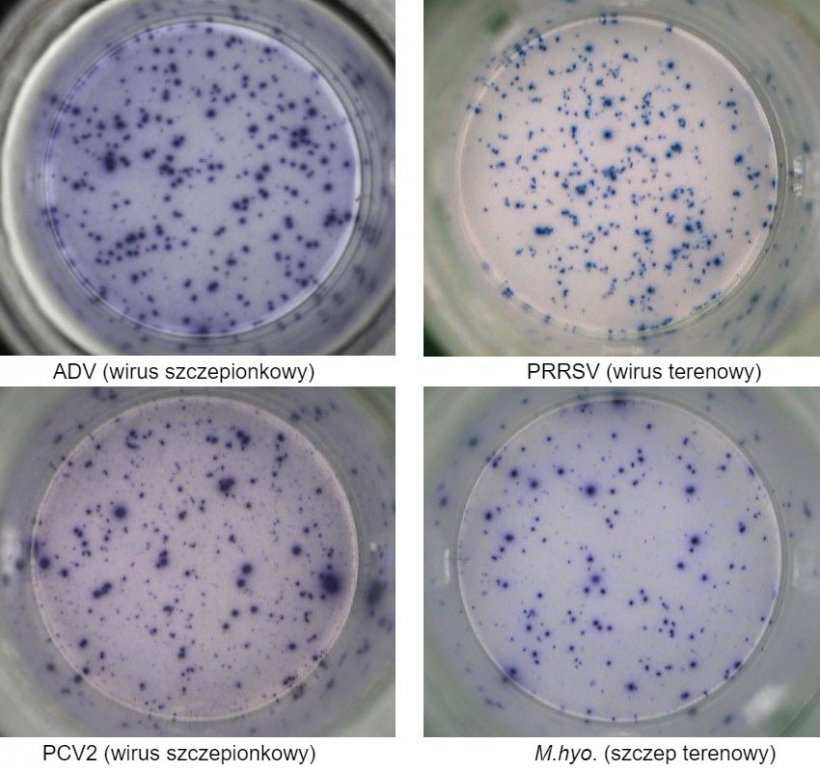
Ryc. 1. IFN-γ ELISPOT odpowiedzi swoiste dla antygenu w PBMC dla patogenów świń. ADV: wirus choroby Aujeszkyego; PRRSV: wirus zespołu rozrodczo-oddechowego świń; PCV2: cirkowirus świń typu 2; M.hyo .: Mycoplasma hyopneumoniae. Każdy punkt oznacza wydzielanie IFN-γ przez ponownie aktywowane limfocyty T pamięci/efektorowe. W nawiasie podano patogen użyty do ponownego aktywowania komórek w płytkach testowych.
Cytometria przepływowa jest czułą i swoistą techniką, która umożliwia identyfikację (immunofenotypowanie) i określenie ilościowe subpopulacji komórek immunologicznych we krwi obwodowej (PBMC) lub komórek izolowanych z tkanek/narządów immunologicznych, a następnie wybarwionych za pomocą przeciwciał skoniugowanych z fluorochromem, reagujących z głównymi markerami powierzchniowymi lub wewnątrzkomórkowymi.
W związku z tym zmiany w takich podgrupach można obserwować i monitorować podczas określonych eksperymentów na zwierzętach i/lub w terenie, np. szczepiąc lub podając immunostymulanty lub inne leki, jak również podczas eksperymentalnych i naturalnych infekcji. Najczęściej wykorzystywanymi do cytometrii przepływowej markerami są cząsteczki CD z powierzchni komórek odpornościowych, za pomocą których można zidentyfikować kilka podzbiorów monocytów (np. CD172, CD14, CD16, CD163) i limfocytów (CD3, CD4, CD8, CD27, CD1, CD2, CD16, CD14, CD25, CD79).
Ponadto, status aktywacji tych komórek można badać przez wewnątrzkomórkowe barwienie cząsteczek związanych z aktywacją i sekrecją, takich jak cząsteczki prozapalne (np. IL-1, TNF-α, IL-6), odpornościowe cytokiny (np. IL-2, IFN-γ, IL-10) i czynniki ekspresji (np. FoxP3).
Tak więc, poprzez wielokrotne wybarwianie, wielofunkcyjne subpopulacje immunologiczne zdolne do jednoczesnego wytwarzania wielu cytokin można zidentyfikować i zbadać podczas infekcji. Wydaje się, że są to komórki będące w stanie zapewniać ochronę przed patogenami.
![Ryc. 2. Przykłady cytometrii przepływowej fenotypów komórek immunologicznych oznaczanych w procentach lub wartościach bezwzględnych [liczba komórek/ml krwi]) w PBMC: ac) subpopulacje limfocytów T: CD3 + CD4 + CD8- = limfocyty T pomocnicze (Th) CD3+ CD4+ CD8 + = komórki T pamięci CD3+ CD4-CD8+ = cytotoksyczne limfocyty T (CTL) d-e) prozapalne subpopulacje monocytów: CD172 + CD14 + CD16 + CD172 + CD16 + CD163 + CD172 + CD14 + CD163 + f-g) CD4 + CD25 + FoxP3 + = regulatorowe limfocyty T (Treg).](https://www.3trzy3.pl/3tres3_common/art/pl/2841/cytometria-przepływowa_133277.jpg?w=820&q=1&t=1653979446)
Ryc. 2. Przykłady cytometrii przepływowej fenotypów komórek immunologicznych oznaczanych w procentach lub wartościach bezwzględnych [liczba komórek/ml krwi]) w PBMC: ac) subpopulacje limfocytów T: CD3 + CD4 + CD8- = limfocyty T pomocnicze (Th) CD3+ CD4+ CD8 + = komórki T pamięci CD3+ CD4-CD8+ = cytotoksyczne limfocyty T (CTL) d-e) prozapalne subpopulacje monocytów: CD172 + CD14 + CD16 + CD172 + CD16 + CD163 + CD172 + CD14 + CD163 + f-g) CD4 + CD25 + FoxP3 + = regulatorowe limfocyty T (Treg).
Limfoproliferacja po stymulacji in vitro mitogennymi poliklonalnymi (niespecyficznymi) i monoklonalnymi (np. specyficznymi dla wirusów i bakterii) aktywatorami może być łatwym sposobem oceny reaktywności komórek immunologicznych T, gdy zwierzę jest poddawane leczeniu, które może zmienić odpowiedź na mitogeny lub antygeny patogenów, które prowokują proliferację i indukują przejście od stanu spoczynkowego do aktywowanych komórek proliferujących (tj. zwanych limfoblastami).
Limfoproliferację można ocenić za pomocą testu MTT (przyłączanie i zmiana zabarwienia odczynnika przez komórki namnażające się), ale także cytometrii przepływowej przez oznaczenie ilościowe limfoblastów (komórek dużego rozmiaru) i/lub włączanie fluorescencyjnych reagentów proliferacji po stymulacji in vitro przez 2-5 dni.

Technologię tetrameru wykorzystano u świń do oznaczania ilościowego za pomocą cytometrii przepływowej specyficznych dla antygenu limfocytów T CD8 + cytolitycznych/cytotoksycznych, a ostatnio do oznaczenia ilościowego komórek B specyficznych względem antygenu.
Oparta ona jest na wykorzystaniu makrocząsteczek fluorescencyjnych obciążonych antygenem, które są wystawione na mieszaną populację komórek odpornościowych w celu interakcji z komórkami B i T, które selektywnie rozpoznają antygen i prawdopodobnie odpowiadają za skuteczność odpowiedzi komórkowej i zmniejszenie ilości patogenu w ciele zwierzęcia. Jest to bardzo swoista i czuła metoda, która jest w stanie wykryć pomniejsze frakcje komórek B i T pamięci. Dla przykładu, opracowano go do rozpoznawania specyficznych dla wirusa pryszczycy (FMDV) i specyficznych dla wirusa świńskiej grypy (SIV) CD8 + cytotoksycznych limfocytów T oraz limfocytów B specyficznych dla PRRSV.
W teście cytotoksyczności wykorzystuje się uprzednio wyizolowane cytolityczne/cytotoksyczne limfocyty T efektorowe (E), a następnie inkubuje się je przez 3-4 dni w 96-studzienkowych płytkach z komórkami docelowymi (T) w różnych proporcjach (E/T); skuteczność cytolizy dostarcza informacji o potencjale immunologicznym efektorowych komórek T przeciwko potencjalnie zakażonym komórkom docelowym in vivo.





