Diagnostyka PRRS ewoluowała przez lata, dzięki czemu obecnie zawiera wiele cennych opcji badań. Rodzaj zwierząt, od których mają być pobrane próbki i charakter procedury pobierania próbek zależą od scenariusza, dla którego wykonujemy badanie: czy powinniśmy badać maciory, prosięta, tuczniki, czy wszystkie? Czy przeprowadzamy próbkowanie celowe czy losowe próbkowanie populacji? I jaka powinna być ilość pobranych próbek? Musimy także zdecydować o rodzaju próbki: czy pobieramy surowicę, tkanki, płyny ustne, czy nasienie? I na koniec, nie możemy zapomnieć o wszystkich pytaniach dotyczących stadium choroby w momencie pobierania próbek. Kiedy pojawiły się objawy kliniczne i czy oczekujemy, że test diagnostyczny wykryje wirusa, zidentyfikuje zmiany patologiczne, czy wykryje przeciwciała? Wreszcie, niezwykle ważne jest, abyśmy rozumieli zalety i ograniczenia każdego testu diagnostycznego.
Zrozumienie każdej z opcji i wybór właściwej strategii diagnostycznej dla każdego scenariusza, dla którego musimy wykonać pobieranie w kierunku PRRS, zwiększy skuteczność każdego programu zarządzania zdrowiem stada.
Scenariusze, dla których wykonujemy próbobranie w kierunku PRRS

Najbardziej oczywistym scenariuszem jest badanie obecności choroby, kiedy objawy potencjalnej epidemii PRRS pojawiają się w negatywnym lub stabilnym pod wzgledem PRRS gospodarstwie. W takim przypadku badanie jest przeprowadzane przez weterynarzy w celu zrozumienia przyczyny objawów klinicznych i pochodzenia patogenu powodującego problemy. Innym bardzo częstym scenariuszem jest monitorowanie braku PRRS w stadzie, który wcześniej było dodatnie i niestabilne, gdzie podjęto strategię kontroli lub zwalczania i należy sprawdzać status i postępy. Wreszcie, testy PRRS są niezwykle powszechne do celów monitorowania choroby. W tym ostatnim scenariuszu badania są przeprowadzane na gospodarstwach ujemnych i zwykle wymagają większej liczby próbek, aby zmaksymalizować stopień pewności statusu populacji wolnej od PRRS.
Nasze cele diagnostyczne kierują wyborem testu
Historycznie podzieliliśmy testy PRRS na 3 typy:
- Te, które wykrywają zmiany: obserwacje pośmiertne i histopatologia, które można wykonać tylko w laboratorium pod mikroskopem. Testy wykrywania zmian najczęściej stosuje się wcześnie, w klinicznie oczywistych wybuchach PRRS;
- Te, które wykrywają wirusa: reakcje łańcuchowe polimerazy (PCR), izolacja wirusa (VI) i testy immunohistochemiczne (IHC). Wykrywanie wirusów jest najbardziej niezawodnym narzędziem diagnostycznym do wczesnego potwierdzania obecności wirusa;
- Te, które wykrywają przeciwciała: test immunoenzymatyczny (ELISA), test monowarstwowy immunoperoksydazowy (IPMA) i pośredni test immunofluorescencyjny (IFA). Immunologiczne potwierdzenie kontaktu z PRRSV wymaga dłuższego okresu wykrywania, ale potwierdza ekspozycję, gdy nie można wykryć wirusa.
Fot. 1. 96- dołkowa płytka ELISA z płaskim dnem stosowana do serologii PRRSV. Pozytywne próbki wybarwiły się na niebiesko. Źródło: Base Pair Biotechnologies.
Specyfikacja testu warunkuje jego przydatność
Bardzo ważne jest, aby dowiedzieć się, jaka jest CZUŁOŚĆ (SE- sensitivity) i SWOISTOŚĆ (SP- specificity) przy rozważaniu wyboru dowolnego testu. Znajomość tych informacji pomaga właściwie interpretować wyniki i na ich podstawie podjąć adekwatne działania.
- SE to zdolność testu diagnostycznego do prawidłowej identyfikacji prawdziwie dodatnich próbek. Test z niskim SE da zbyt wiele wyników fałszywie ujemnych.
- SP to zdolność testu diagnostycznego do prawidłowej identyfikacji prawdziwie ujemnych próbek. Test z niskim SP da zbyt wiele fałszywie dodatnich wyników.
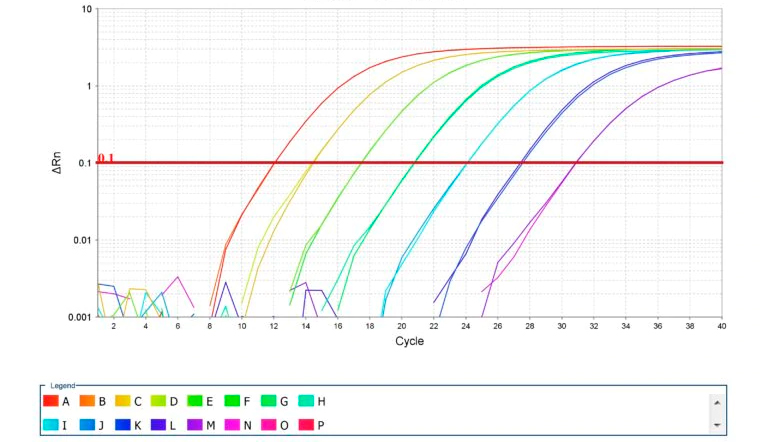
Fot. 2. Amplifikacja krzywych standardowych dla qPCR. Źródło: Thermo Fisher Scientific Inc.
Możliwości diagnostyczne w scenariuszach PRRS
Wszystkie scenariusze i opcje diagnostyczne zestawiono w Tabeli 1.
1. Badanie wystąpienia wybuchu choroby: W przypadku gospodarstwa doświadczającego wybuchu choroby, celem protokołu diagnostycznego będzie potwierdzenie zakażenia i, jeśli to możliwe, genetyczna charakterystyka szczepu. Wczesne zaangażowanie weterynaryjne w wybuch choroby pomoże skutecznie osiągnąć te cele. Jeśli obecne są świnie z klasycznymi objawami klinicznymi, zdecydowanie zaleca się ukierunkowane pobieranie próbek od tych zwierząt w celu stwierdzenia makroskopowych zmian chorobowych. Po zidentyfikowaniu charakterystycznych zmian (tj. ciężkich, nie zapadniętych płuc o marmurkowym wyglądzie) w terenie, należy wykonać PCR i histopatologię w celu potwierdzenia diagnozy. Należy także przeprowadzić sekwencjonowanie genetyczne w celu zidentyfikowania szczepu. Sekwencjonowanie jest kluczem do zrozumienia epidemiologii (tj. pochodzenia, czy jet to szczep miejscowy, czy nowo pojawiający się) potencjalnego nowego wirusa poprzez porównanie z innymi znanymi już szczepami.
2. Monitoring choroby: W gospodarstwie z pozytywnym wynikiem PRRSV, w celu zminimalizowania negatywnego wpływu choroby z powodu niestabilności produkcji, należy jak najszybciej wdrożyć programy kontrolne (po których czasem następuje ereadykacja) w celu wyprodukowania negatywnych prosiąt. Celem programu diagnostycznego w tym przypadku będzie wykazanie kluczowych parametrów wskazujących stabilność PRRS (tj. aklimatyzacja loszek, odporność stada hodowlanego i produkcja ujemnych prosiąt). Serologia służy do potwierdzenia skutecznej ekspozycji loszek i stada hodowlanego, a PCR służy do potwierdzenia braku wirusa u nowonarodzonych i odsadzonych prosiąt. W tych warunkach stosujemy testy o wysokim SE (tj. najmniejszej możliwej liczbie fałszywie ujemnych). Ponieważ mamy do czynienia z fermą, w której spodziewana częstość występowania prosiąt pozytywnych pod względem PRRS może być bardzo niska lub nieobecna, wymagana będzie duża liczba próbek w celu potwierdzenia statusu PRRS z dużym stopniem pewności. Zakładając brak prosiąt z kliniczną postacią choroby, losowo wybrane prosięta i nowo wprowadzone ujemne loszki w gospodarstwie są naszymi najlepiej ukierunkowanymi populacjami do pobierania próbek. Większość rodzajów próbek (tj. surowica, płyny ustne, płyny technologiczne pochodzące z kastracji i obcinania ogonów, tkanki) jest wartościowych, ale ważne jest, aby zrozumieć różnice SE i SP między testami podczas oceny wyników. W miarę możliwości należy zawsze brać pod uwagę pulowanie, aby analiza była tańsza.
3. Nadzór nad chorobą: Prowadząc nadzór nad chorobami w gospodarstwach ujemnych, zwykle wybieramy testy o możliwie najwyższym SP (tj. najmniej wyników fałszywie dodatnich). Farmy te (tj. ośrodki inseminacji lub namnażania) przy wielu okazjach muszą rutynowo dokumentować swój status. W przypadku ferm loch test ELISA jest najlepszą opcją do wykazania braku ekspozycji na PRRS. Jest niedrogi, szybki i ma dobre SE i SP. W tych gospodarstwach często przeprowadza się ponowny test serologiczny w celu ustalenia, czy nieoczekiwane wyniki dodatnie (zwykle 1–2% wszystkich próbek) są prawdziwe, czy fałszywie dodatnie. Pośredni test immunofluorescencyjny (IFA) lub test mono-warstwowy immunoperoksydazowy (IPMA), oba oparte na pośrednim barwieniu wstępnie przygotowanych monowarstw zainfekowanej komórki, służą jako testy potwierdzające nieoczekiwany pozytywny wynik testu ELISA. PCR jako test wczesnego wykrywania stosuje się na: 1) płynach ustnych przed dostawą loszek zastępczych w wieku rozrodczym; oraz 2) surowicy lub krwi od knurów w centrach inseminacji.
Podsumowując, wybór odpowiednich testów we właściwym czasie i na odpowiednio dobranych zwierzętach oraz ich poprawna interpretacja zwiększy szybkość, dokładność i opłacalność naszych strategii diagnostycznych PRRS.

Tabela 1. Podsumowanie scenariuszy i strategii diagnostycznych
Badanie wystąpienia wybuchu choroby
- Status PRRS fermy
- Niestabilna
- Aktywna transmisja wirusa
- Nowe wprowadzenie PRRS
- Wysoka prewalencja choroby
- Cele diagnostyczne
- Wykrycie zakażenia
- Identyfikacja szczepu PRRSV
- Zwierzęta
- Te z objawami klinicznymi
- Martwo urodzone
- Typy próbobrania
- Próbobranie celowane
- Niewielka liczba zwierząt
- Pulowanie próbek
- Próbka
- Tkanka
- Surowica
- Pierwsza opcja diagnostyczna
- Sekcja w celu identyfikacji zmian
- Zalety
- “Bardzo szybka”
- Na fermie
- Tania
- Wady
- Niskie SE/SP
- Druga opcja diagnostyczna
- PCR/ sekwencjonowanie wirusa w celu wykrycia/ zidentyfikowania szczepu PRRSV
- Zalety
- Wysokie SE/SP
- Szybkie, 24h
- Wyniki ilościowe (RT-qPCR)
- Wady
- Potencjalnie fałszywie dodatnie ze względu na ryzyko kontaminacji: konieczne zapewnienie odpowiedniego obchodzenia się z próbką (podczas próbobrania i dalszych procesów)
Monitoring choroby
- Status PRRS fermy
- Stabilny
- Szczep PRRSV będący w fermie od dłuższego czasu
- Niska prewalencja choroby
- Cele diagnostyczne
- Monitoring stabilności/ kontroli
- Monitoring programów eradykacji
- Zwierzęta
- Prosięta (noworodki i odsadzone)
- Loszki
- Typy próbobrania
- Próbobranie losowe/ duża liczba zwierząt
- Próbobranie celowane/ mniejsza liczba zwierząt
- Próbki pulowane
- Próbka
- Płyn ustny
- Surowica
- Płyny technologiczne
- Płyny z języków prosiąt
- Pierwsza opcja diagnostyczna
- PCR w celu wykrycia materiału genetycznego (RNA) od ≈7 dni od początku infekcji
- Zalety
- Wysokie SE/SP
- Szybki 24h
- Wyniki mogą być ilościowe (RT-qPCR)
- Wady
- Potencjalnie fałszywie dodatnie ze względu na ryzyko kontaminacji: konieczne zapewnienie odpowiedniego obchodzenia się z próbką (podczas próbobrania i dalszych procesów)
- Druga/ alternatywna opcja diagnostyczna
- ELISA w celu wykrycia przeciwciał (IgM, IgG, N) od ≈14 dni od początku infekcji
- Zalety
- Niski koszt w przeliczeniu na próbkę
- Wyniki w ciągu 2-4 dni
- Potwierdza brak zetknięcia się z wirusem w przeszłości
- Wady
- Niższe SP
- Nie różnicuje ekspozycji szczepionkowej od terenowej
- Wyniki nie są ilościowe
Nadzór nad chorobą
- Status PRRS fermy
- Ferma PRRS ujemna
- Cele diagnostyczne
- Upewnienie się co do statusu ujemnego
- Zwierzęta
 |
|
4. Typy próbobrania
|
4. Typy próbobrania
|
|
5. Próbka
|
5. Próbka
|
|
6a. Pierwsza opcja diagnostyczna (stado loch, loszki, prosięta)
6b. Pierwsza opcja diagnostyczna (Loszki rozrodowe remontowe)
7. Druga opcja diagnostyczna
|
6. Pierwsza opcja diagnostyczna
|