1. Droga pokarmowa
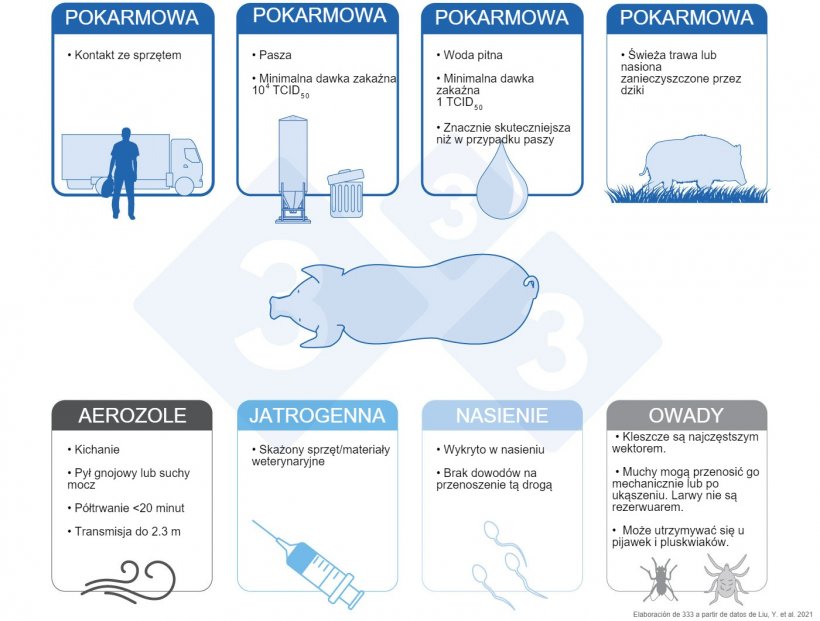
Najważniejszymi drogami przenoszenia wirusa afrykańskiego pomoru świń (ASFV) są drogi pokarmowe, głównie poprzez spożycie paszy i/lub kontakt ze sprzętami/przedmiotami zanieczyszczonymi cząstkami wirusa. Trwałość wirusa, jak również trudności w jego inaktywacji (Tabela 1) przyczyniają się do tego, że jest on trudny do zwalczenia.
Świnie, które spożyły paszę skażoną szczepem Georgia 2007/1, zostały zakażone minimalną dawką zakaźną 104 TCID50, przy medianie 106,8 TCID50. W tym samym badaniu minimalna dawka infekcyjna ASFV w wodzie pitnej wynosiła zaledwie 1 TCID50 z medianą 10 TCID50, co wskazuje, że przenoszenie ASFV przez wodę pitną jest znacznie bardziej efektywne niż przez paszę (Niederwerder et al. 2019).

Historycznie wykazano, że spożycie resztek pokarmu przeznaczonego dla ludzi lub zlewek stanowi ważną drogę rozprzestrzeniania się ASFV.
Świeża trawa i nasiona zanieczyszczone przez zakażone dziki są potencjalnym źródłem zakażenia dla świń domowych (Guinat et al. 2016).
Tabela 1. Zdolność do zakażenia ASFV w różnych warunkach (Źródło: Liu, Y. et al. 2021).
| Parametr | Zdolność do zakażenia | Źródło |
|---|---|---|
| Temperatura | 37ºC – 11-21 dni |
Mazur-Panasiuk et al. 2019 Juszkiewicz et al. 2019 |
| 56ºC – 60 -70 minut | ||
| 60ºC – 15-20 minut | ||
| Krew | Przechowywanie w 4ºC – 18 miesięcy | Beltrán-Alcrudo et al. 2017 |
| Rozkładająca się krew – 15 dni | ||
|
Gnojowica |
Kał w 4ºC – 8 dni |
Davies et al. 2017 |
| Kał w 37ºC – 3-4 dni | ||
| Mocz w 4ºC – 15 dni | ||
| Mocz w 21ºC – 5 dni | ||
| Mocz w 37 ºC – 2-3 dni | ||
| Wieprzowina | Wieprzowina w 4-8ºC – 84-155 dni |
Mazur-Panasiuk et al. 2019 Beltrán-Alcrudo et al. 2017 |
| Solona wieprzowina: 182 dni | ||
| Suszona: 300 dni | ||
|
Gotowana (minimum 30 min. w 70ºC): 0 dni |
||
| Wędzona: 30 dni | ||
| Mrożona: 1000 dni | ||
| Chłodzona: 100 dni | ||
| Woda | W temp. pokojowej: 50 dni |
Sindryakova et al. 2016 Mazur-Panasiuk et al. 2019 |
| Pasza | W temp. pokojowej: 1 dzień |
2. Przenoszenie z aerozolem
Świnie zakażone wirusem ASF wydalają go do środowiska poprzez wydaliny i wydzieliny, a ładunek wirusowy w płynie ustnym, płynie nosowym, kale i moczu jest szczególnie wysoki podczas ostrej fazy (MacLachlan et al. 2017). Gdy świnie wykazują objawy oddechowe, takie jak kichanie i/lub kaszel, wydzieliny te mogą stać się aerozolami przenoszącymi wirusa. Kiedy skażony wirusem kał lub mocz wysycha, wznoszony pył/kurz spowodowany przemieszczaniem się zwierząt może również generować unoszenie się w powietrze aerozoli z cząsteczkami wirusa (De Carvalho Ferreira et al. 2013).
Okres półtrwania ASFV w powietrzu wynosi 19,2 minuty (badanie qPCR) i może być przenoszony na odległość do 2,3 metra pomiędzy zakażonymi i podatnymi świniami.
Podsumowując, ASFV może być przenoszony w obrębie gospodarstwa w postaci aerozoli, co może być ważnym sposobem transmisji ASFV na fermach świń.
3. Transmisja jatrogenna
ASFV może rozprzestrzeniać się z zakażonych świń na świnie wrażliwe poprzez zanieczyszczony sprzęt/materiały weterynaryjne, takie jak igły używane do szczepień (Penrith et al. 2009 & Beltran-Alcrudo et al. 2017). Jednak skuteczność jatrogennego zakażenia i jego znaczenie w epidemiologii ASFV pozostają niejasne.
4. Transmisja z nasieniem
Chociaż nie ma bezpośrednich dowodów na to, że ASFV jest przenoszony przez nasienie (Mazur-Panasiuk i wsp. 2019), istnieją badania wskazujące na możliwość wykrycia ASFV w nasieniu od zakażonych knurów (Thacker i wsp. 1984).
5. Transmisja poprzez owady
ASFV może replikować się w kleszczach (Ornithodoros spp) i są one najczęstszym wektorem wirusa (Mazur-Panasiuk et al. 2019). Kleszcze te żyją w gniazdach dzików, a dorosłe osobniki mogą żyć przez dziesiątki lat i przetrwać przez długi czas bez jedzenia, co czyni kleszcze Ornithodoros idealnym rezerwuarem dla wirusa. Inne owady również mogą roznosić ASFV. Mucha stajenna (Stomoxys calcitrans) może przenosić wirusa mechanicznie na podatne świnie (Mellor et al. 1987) i może również przenosić go przez ugryzienie. W chwili obecnej rola much w epidemiologii i przenoszeniu ASF nie jest całkowicie jasna. Larwy much nie są rezerwuarem dla ASF i nie mogą mechanicznie rozprzestrzeniać wirusa (Forth i wsp. 2018). Ostatnie badania wykazały, że ASF może utrzymywać się u pijawek (Hirudo medicinalis) i pluskwiaków (rodzina: Reduviidae, podrodzina: Triatominae) (Karalyan et al. 2019 & Golnar et al. 2019)
.
Liu, Y., Zhang, X., Qi, W., Yang, Y., Liu, Z., An, T., Wu, X., & Chen, J. (2021). Prevention and Control Strategies of African Swine Fever and Progress on Pig Farm Repopulation in China. Viruses, 13(12), 2552.
Redakcja 333


















