Konsorcjum PRRS i Genetyki Świni (PRRS Host Genetics Consortium - PHGC) stworzono wspólnie z Joan Lunney (ARS USDA) i Jackiem Dekkersem (Iowa State University), w celu opracowania narzędzi genetycznych i genomicznych dla zmiejszenia wpływu PRRS na zdrowie świń. Dla osiągnięcia tego celu wykorzystano najnowsze zdobycze wirusologii, immunologii, genetyki i genomiki. Główne cele przedsięwzięcia to zastosowanie wyników badań w stadach komercyjnych. Uprzednie wysiłki identyfikacji genów odpowiedzialnych za oporność na choroby skupiały się na porównywaniu odpowiedzi na zakażenie u świń z różnych czystych linii genetycznych. Konsorcjum PHGC nie zajmuje się porównywaniem ras lecz skupia się na identyfikacji markerów oporności/wrażliwości obecnych w populacjach stad komercyjnych wykazujących zmienność w obrazie choroby. W modelu PHGC wykorzystano doświadczalne zakażenie 200 młodych świń dobrze scharakteryzowanym szczepem wirusa PRRS. Dla każdej świni zarejestrowano charakterystyczne cechy przebiegu zakażenia takie jak śmiertelność, poziom wirusa w surowicy, przyrosty masy ciała, poziom przeciwciał neutralizujących i poziom cytokin w surowicy (Ryc. 1). Genotypowanie wszystkich osobników wykonane przy użyciu czipu DNA 60K SNP i dokładna analiza genomu pod kątem związków z charakterystycznym przebiegiem choroby pozwoliło na identyfikację kilku markerów związanych z określonymi objawami i opornością. Jeden z korzystnych alleli w obszarze markera w chromosomie 4 Sus scrofa (SSC4) jest związany z większymi przyrostami i obniżonym poziomem wirusa w surowicy. W czasie 42 dni po zakażeniu świnie o tym genotypie przyrastały około 10% lepiej i wykazywały niższy poziom wiremii, niż pozostałe zwierzęta. Efekt ten jest zobrazowany na Ryc. 1. Dotychczasowe wyniki badań wskazują, że podobny korzystny efekt może być zaobserwowany również w warunkach standardowej fermy.
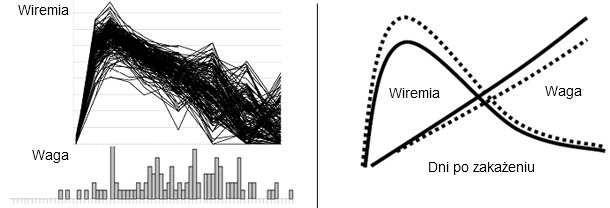

| Ryc.1. Skutki zakażenia PRRSV na poziomie populacji. Powyższa rycina przedstawia wiremię PRRSV (góra) i rozkład przyrostów masy ciała (dół) u 200 świń zakażonych doświadczalnie PRRSV. Świnie zakażono w 3 tygodniu życia a dane zbierano w ciągu 42 dni po infekcji. | Ryc. 2. Pozytywny efekt obecności korzystnego markera w SSC4 na przyrosty i wiremię u młodych świń. Powyższy model pokazuje spodziewaną poprawę w przyrostach i obniżeniu poziomu wiremii u świń posiadający pozytywny allel (AB lub BB, linia ciągła) w porównianiu do świń posiadających genotyp AA (linia przerywana). Zwiększenie przyrostów na poziomie 10%. Obniżenie wiremii o około 1 log. |
Inne cechy przebiegu zakażenia są związane z różnymi aspektami odpowiedzi odpornościowej na infekcję PRRSV. Stwierdziliśmy między innymi odwrotną zależność między poziomem wiremii a mianem przeciwciał neutralizujących. W dodatku niewielki odsetek zakażonych świń wykazywał unikalną odpowiedź humoralną, o bardzo szerokim spektrum neutralizacyjnym, włączając w to szczepy należące do odmiennego genotypu (europejskiego, typ 1). Mimo, że nie odkryto dziedzicznego elementu odpowiedzialnego za odpowiedź neutralizacyjną, poziom odpowiedzi przeciwko białku N udało się powiązać z dziedzicznym markerem związanym z SNP w SSC7. Marker w SSC1 jest skorelowany z ostrymi objawami oddechowymi w przebiegu zespołu zaburzeń oddechowych świń (PRDC). Marker jest zlokalizowany w pobliżu genu receptora cytokin.
Wyniki badań konsorcjum PHGC są ważne z wielu względów. Po pierwsze, obraz kliniczny po zakażeniu PRRSV zależy w znacznym stopniu od cech dziedzicznych. Po drugie, stosunkowo niewielka liczba markerów genomowych jest związana z danym fenotypem choroby. Jest więc możliwe zastosowanie selekcji świń w celu uzyskania korzystnej odpowiedzi na zakażenie. Również, jak dotychczas wszystkie markery związane z występowaniem określonych objawów klinicznych i odpowiedzi odpornościowej są zlokalizowane w regionach genomu zawierających geny ważne z punktu widzenia immunologii jak geny stymulowane interferonem, MHC i geny odpowiedzi cytokinowej. Genomika i genetyka dostarczają nowych narzędzi poprawy zdrowia zwierząt, szczególnie w odniesieniu do chorób zakaźnych, przeciw którym brak jest skutecznych szczepionek lub metod leczenia. Jeśli uda się ulepszyć genetykę świń i powiązać to z udoskonalonymi szczepionkami i zoptymalizowanym żywieniem, możliwe będzie wyeliminowanie wielu negatywnych efektów endemicznego PRRS.