PRRSV i wirus grypy należą do różnych rodzin o różnych mechanizmach patogenności, ale oba wirusy mają pewne cechy wspólne:
- Wysoka różnorodność genetyczna: Oba wirusy mają bardzo wysoki wskaźnik mutacji i chociaż robią to za pomocą różnych mechanizmów, oba mają zdolność do wymiany części segmentu swojego genomu.
- Wysokie rozpowszechnienie: >70% hiszpańskich gospodarstw ma dodatni wynik w obu przypadkach.
- Zdolność do endemicznego występowania na farmach:
- IAV: Postać endemiczna jest wynikiem obecności subpopulacji o różnych poziomach odporności w gospodarstwie. Różnica w „doświadczeniu” immunologicznym u młodszych i starszych loch może wpływać na występowanie infekcji w porodówkach, gdzie prosięta urodzone przez młode lochy są bardziej narażone na zakażenie. Ta wczesna transmisja zwykle odbywa się poziomo, między miotami, a nawet przez sprzęt. U loch w fazie laktacji opisywano serokonwersję, co wskazuje, że prosięta mogą być źródłem zakażenia dla loch. Najczęściej prosięta zarażają się w odchowalni, gdy poziom przeciwciał matczynych spada. W dotkniętych chorobą odchowalniach zwykle obserwuje się zwiększoną częstość występowania IAV, związaną ze zwiększonymi parametrami klinicznymi (kichanie, kaszel i silny kaszel).
- PRRS: Transmisja pionowa jest powszechna, a prosięta rodzące się z wiremią są kluczem do utrzymania cyklu infekcji w gospodarstwie. Im większa liczba prosiąt rodzi się z wiremią, tym większa jest pozioma transmisja podczas fazy odchowu.
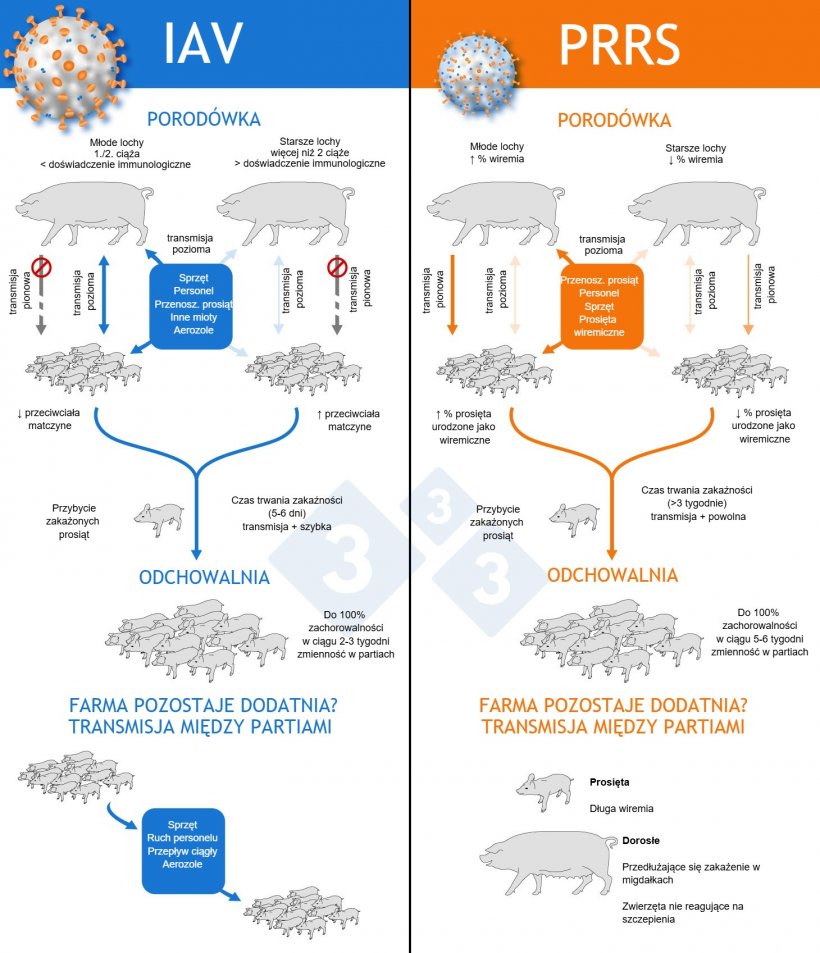

W swoich endemicznych formach oba wirusy mają średnio podobne wartości transmisji R₀ (między 2 a 7), ale różnią się czasem trwania zakaźności.
- W przypadku PRRSV jest on znacznie dłuższy (>3 tygodnie u prosiąt).
- W przypadku IAV jest on krótszy (średnio 5-7 dni), więc transmisja następuje szybciej. Nawet w sytuacjach endemicznych można zaobserwować transmisje epidemiczne, osiągając ponad 10 zakażeń od pojedynczego zwierzęcia w niektórych kojcach lub partiach, co jest rzadko obserwowane w przypadku PRRSV w sytuacjach endemicznych.
Interakcje z innymi patogenami: różne sposoby działania
Innym powszechnym aspektem jest wzrost wtórnych infekcji bakteryjnych. Ponownie, przyczyny nie są takie same:
- IAV: Wirus powoduje zniszczenie nabłonka rzęskowego i bardzo intensywny stan zapalny w drogach oddechowych. Ułatwia to kolonizację przez patogeny bakteryjne, które mogą dotrzeć do płuc, zwiększając częstotliwość wtórnego bakteryjnego zapalenia płuc.
Opisano wyraźne synergie między IAV i Mycoplasma hyopneumoniae oraz z Actinobacillus pleuropneumoniae.
- PRRSV (szczepy konwencjonalne): Zakażenie jest ograniczone do makrofagów podatnych na infekcję, które występują rzadko w górnych i środkowych drogach oddechowych, a przede wszystkim w pęcherzykach płucnych i naczyniach płucnych. Stan zapalny w płucach może być znaczny, ale nie ujawnia się istotnie w innych tkankach. Objawy kliniczne związane z pierwotnym zakażeniem PRRSV są zmienne na poziomie układu oddechowego, co nie oznacza, że nie mogą być poważne. W zależności od zjadliwości każdego szczepu, zakażenie wiąże się z pogorszeniem odpowiedzi immunologicznej, a także niedoborem makrofagów pęcherzykowych. Ułatwia to wnikanie innych bakterii, zwiększając częstość występowania zapalenia płuc i ogólnoustrojowych infekcji bakteryjnych. Opisano również synergię między PRRSV i PCV2.
- PRRS (szczepy wysokozjdliwe): Zapalenie jest znacznie bardziej widoczne i powoduje uszkodzenie układu oddechowego z bardzo wyraźnymi objawami klinicznymi i występownaiem upadków u ziwerząt od samego początku infekcji. Jeśli zwierzęta przeżyją infekcję, przez długi czas są wyraźnie predysponowane do infekcji bakteryjnych, ponieważ infekcja ta wiąże się z atrofią grasicy i bardzo wyraźną limfopenią.
Interakcja między IAV i PRRSV u świń
Interakcja między tymi dwoma wirusami jest złożona, co sprawia, że sprzeczne wyniki nie są rzadkością. W badaniu eksperymentalnym Van Reeth i wsp. zbadali współzakażenie PRRSV i IAV w dwóch grupach zwierząt. Podczas gdy w jednej grupie zaobserwowano wyraźną synergię między dwoma wirusami, w drugiej grupie zaobserwowano łagodniejszy obraz kliniczny niż oczekiwano dla każdego z wirusów osobno.
W nowszym badaniu (Martín-Valls i in., 2022) obecność jedenastu wirusów układu oddechowego, w tym IAV, PRRSV1, PCV2, cytomegalowirusa świń (PCMV), koronawirusa oddechowego świń (PRCV) i ortopneumowirusa świń (SOV), oceniano na poziomie indywidualnym i fermowym. Wyniki na poziomie gospodarstwa wykazały związek między IAV, PCMV i SOV, ale nie z wirusem PRRS. Na poziomie indywidualnym IAV i wirus PRRS korelowały ujemnie. Ta ujemna korelacja została również opisana in vitro w badaniu, w którym zaobserwowano zakłócenia replikacji we współzakażonych komórkach nabłonka CD163+. W innym eksperymentalnym badaniu in vivo, wcześniejsze zakażenie PRRSV negatywnie wpływało na zakażenie IAV.
Jednak w niedawnym badaniu, w którym oceniano jednoczesne krążenie tych dwóch wirusów w populacjach świń obserwowanych podłużnie od urodzenia do końca fazy odsadzenia, zaobserwowano, że obecność wysoce zjadliwego wirusa PRRS spowodowała:
- wzrost liczby zwierząt wielokrotnie zakażonych IAV,
- wydłużenie czasu trwania infekcji IAV (w niektórych przypadkach ponad 2 tygodnie). Może to być związane z pogorszeniem odpowiedzi immunologicznej tych zwierząt.
Bardzo trudno jest ocenić wpływ na produkcję i zdrowie. Cornelison i wsp. porównali dwie fermy współzakażone PRRSV i IAV z fermą zakażoną tylko PRRSV i zaobserwowali wzrost śmiertelności o 19% w fermach współzakażonych oraz zmniejszenie średniego dziennego przyrostu (skumulowanego do wieku ubojowego) o 8-14%.
Wniosek
Związek między tymi wirusami jest złożony i badania dają sprzeczne wyniki. Pojawienie się wysoce patogennych szczepów PRRSV i wysoka różnorodność genetyczna obu wirusów sprawiają, że bardzo trudne (jeśli nie niemożliwe) jest przewidzenie względnego wpływu każdego z nich. Chociaż najwyraźniej nie sumują się one na poziomie indywidualnym, ich wpływ zarówno osobno, jak i w połączeniu na poziomie gospodarstwa jest bardzo wyraźny.




