Objawy kliniczne
Większość zakażeń M.hyopneumoniae ma postać subkliniczną. W przypadku wystąpienia objawów klinicznych, suchy i nieproduktywny kaszel jest najbardziej typowym objawem. W warunkach zakażeń doświadczalnych, kaszel pojawia się od 10 do 14 dni po zakażeniu, osiąga swoje maksimum w około 4-5 tygodniu, po czym stopniowo znika. W warunkach terenowych kaszel może być obecny w odchowalni, warchlakarni i na tuczu i zazwyczaj dotyka znacznego odsetka świń. W przypadku równoczesnych zakażeń innymi patogenami układu oddechowego, objawy kliniczne i zmiany w płucach są cięższe. Zakażenie M. hyopneumoniae prowadzi do wzrostu współczynnika wykorzystania paszy, niższego średniego dziennego przyrostu masy ciała, i większej zmienności masy ciała pomiędzy świniami.

M. hyopneumoniae jest jednym z najważniejszych czynników chorobotwórczych w zespole chorobowym układu oddechowego świń (PRDC). PRDC obejmuje zarówno czynniki bakteryjne (potencjalnie zaangażowane w enzootyczne zapalenie płuc) jak i wirusowe (wirus zespołu rozrodczo- oddechowego świń (PRRSV), cirkowirus świń typu 2, wirus choroby Aujeszkyego, wirusy influenzy świń oraz koronawirus oddechowy). Klinicznie, u zwierząt przeznaczonych na tucz, PRDC wyraża się poprzez powolne przyrosty, zmniejszenie wydajności w wykorzystaniu paszy, brak apetytu, gorączkę, kaszel i duszność.
Diagnostyka
Wstępna diagnostyka mykoplazmowego zapalenia płuc opiera się na objawach klinicznych (przewlekły, nieproduktywny kaszel i niska wydajność), typowe makroskopowe zmiany w dogłowowo- brzusznych częściach płuc (zdjęcie) i obecność charakterystycznych okołooskrzelowych i okołonaczyniowych nacieków i guzków w obrazie histopatologicznym. Jednak ani objawy kliniczne, ani zmiany w płucach nie są patognomoniczne dla M. hyopneumoniae. Ponadto powszechne są infekcje mieszane, co skutkuje pojawianiem się objawów i uszkodzeń, które nie są typowe dla M. hyopneumoniae.
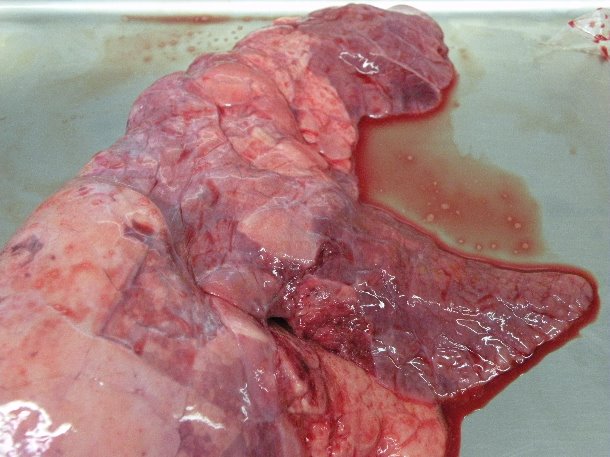
Nieżytowe zapalenie dogłowowo- brzusznych części płuc po eksperymantalnym zakażeniu M. hyopneumoniae .
Zarówno objawy kliniczne jak i powstałe zmiany zostały poddane punktacji za pomocą systemów scoringowych. Indeks kaszlu, zależny od liczby zwierząt kaszlących w danym okresie czasu, wykazał, że odpowiada to profilowi zakażenia M. hyopneumoniae w warunkach terenowych (Maes i wsp, 1999;. Nathues et al 2012). Uszkodzenia płuc mogą być oceniane w czasie sekcji padłych zwierząt lub w ubojni. W celu rzetelnego oszacowania częstości występowania i nasilenia zmian w płucach na poziomie stada, powinno się poddać monitoringowi płuca co najmniej 30 zwierząt (Davies i in., 1995). Kontrole poubojowe są przydatne w wykrywaniu subklinicznych infekcji dróg oddechowych, które mogą mieć negatywny wpływ na wydajność tuczu. Większość metod punktacji jest opartych na subiektywnej wizualnej ocenie odsetka powierzchni/objętości płuc dotkniętej zmianami. W związku z tym ocena może być błędna. Obecność ciężkiego zapalenia opłucnej może maskować zmiany chorobowe płuc, a gojenie się zmian w okresie tuczu może prowadzić do wyników fałszywie ujemnych. Stąd subiektywność metody punktacji, regresja zmian w płucach i niespecyficzność tych zmian wyklucza rozpoznanie czynnika etiologicznego w oparciu wyłącznie o badanie zmian przy uboju.
Izolacja M. hyopneumoniae jest nadal uważana za złoty standard w rozpoznawaniu, ale ze względu na fakt, że jest to trudne, kosztowne i czasochłonne, nie jest stosowana w praktyce. Rozstrzygająca diagnoza jest często oparta o wynik badania PCR lub wykrywanie antygenu metodą immunofluorescencji, oraz za pomocą badań serologicznych. Dostępnych jest wiele testów PCR; M. hyopneumoniae może być wykryta w wymazach z nosa i tchawicy, BAL i w tkance płucnej pochodzącej od martwych zwierząt. Wymazy z nosa są łatwe do pobrania ale badanie jest mniej czułe niż w przypadku użycia próbek pochodzących z tchawicy lub płynu BAL. Vranckx i in. (2012) ocenił stopień zakażenia u świń z różnych grup wiekowych w czterech stadach korzystając z qPCR płynu BAL (Rysunek 1). Największą liczbę stwierdzono w starszych grupach wiekowych. Wspomniani autorzy wykazali także dodatnią korelację u świń poddanych ubojowi między ilością wykrytej M. hyopneumoniae określonych poprzez qPCR w płynie BAL, a ciężkością zmian chorobowych płuc. Pobieranie próbek krwi w różnych grupach wiekowych do wykrywania przeciwciał w surowicy krwi umożliwia badanie dużej liczby świń i może oddać strukturę infekcji w stadzie. Przekrojowe pobieranie próbek (w różnych grupach wiekowych podczas jednej wizyty) ma tę zaletę, że szybko uzyskuje się wynik badania. Próbobranie seryjne ma tę zaletę, że ta sama grupa (lub świnie) jest / są badane w dłuższym okresie czasu, oraz że uzyskuje się więcej informacji o przebiegu infekcji w tych grupach. Wyniki badań serologicznych dla M.hyopneumoniae należy interpretować na poziomie grupy. Nie ma współzależności pomiędzy mianami przeciwciał w surowicy i poziomem ochrony przy zastosowaniu obecnie dostępnych testów ELISA. Serokonwersja w zależności od warunków może trwać od 3 do 8 tygodni, a nawet dłużej.
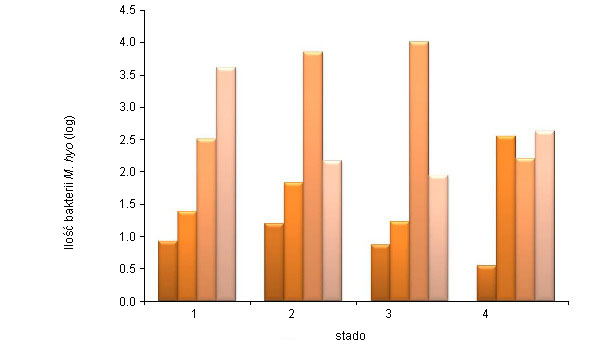
Rysunek 1. Ilość M. hyopneumoniae (średnia log patogenów na ml) określona przez nPCR z popłuczyn oskrzelowych (BAL) u świń 6, 10 i 14 tygodniowych i po uboju z 4 różnych stad (Vranckx et al. 2012)