Modelowanie: dodatkowy element w badaniach terenowych i doświadczalnych
Modelowanie jest coraz częściej wykorzystywane do analizy interakcji w złożonych systemach biologicznych. Jak stwierdził George E.P. Box „wszystkie modele są błędne, ale niektóre są użyteczne”, co podkreśla główny cel modelowania: odzwierciedlenie złożonego systemu poprzez uproszczenie umożliwiające jego analizę przy zachowaniu znaczenia głównych procesów. Modelowanie jest więc ważnym dodatkowym elementem w badaniach obserwacyjnych i doświadczalnych, dzięki któremu możemy stawiać nowe pytania i hipotezy.

Epidemiologiczne badania czynników ryzyka wystąpienia poodsadzeniowego wielonarządowego zespołu wyniszczającego (PMWS) jasno wykazały, że głównym elementem jest dynamika zakażenia PCV2 u świń: im wcześniejsza infekcja tym większe ryzyko wystąpienia choroby. Błędy w zarządzaniu we wczesnym okresie życia świń również stanowią czynniki ryzyka wystąpienia PMWS i sprzyjają transmisji patogenów między zwierzętami. Biorąc pod uwagę możliwą transmisję pionową PCV2 i znaczenie odporności siarowej, mieszanie miotów podejrzewa się o ułatwianie szerzenia się infekcji między zakażonymi i wrażliwymi miotami. Wzajemne relacje między zidentyfikowanymi czynnikami ryzyka PMWS i zmianami w przebiegu zakażenia PCV2 nie są w pełni poznane. W odtworzeniu złożonego systemu populacji w trakcie procesu zakaźnego pomóc może modelowanie takich oddziaływań.
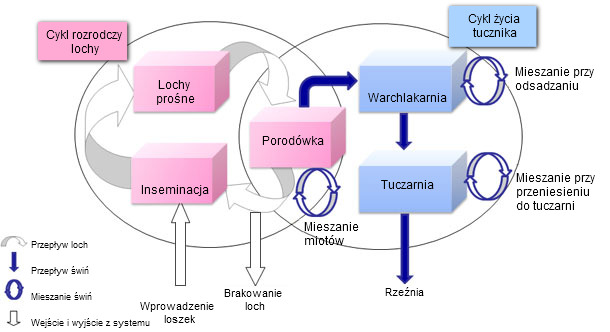
Ryc. 1. Schemat dynamicznego modelu populacji świń
Opracowanie modelu
Model dynamiki populacji zbudowano na podstawie indywidualnej (Ryc. 1). Poziom reprezentacji pozwolił na odtworzenie silnych relacji między statusami zakaźnymi PCV2 u loch, ich potomstwa oraz przemieszczeniami pojedynczych zwierząt. Ponadto, model ten miał charakter stochastyczny i brał pod uwagę biologiczną zmienność różnych parametrów indywidualnych (liczba prosiąt urodzonych w miocie, ronienie lub prawdopodobieństwo śmierci. Z drugiej strony stworzono model epidemiologiczny na podstawie aktualnej wiedzy o przebiegu infekcji PCV2 u pojedynczej świni (Ryc. 2). Rdzeń stanowi model SEIR (wrażliwe-zakażone-zakażające-ozdrowieńcy). Model ten brał pod uwagę specyficzne stany zakaźne reprezentujące transmisję pionową i pseudo-pionową oraz wpływ odporności biernej. W celu realistycznego zaprezentowania przebiegu infekcji PCV2 przeprowadzono doświadczenia nad wykorzystujące transmisję zakażenia. Doświadczenia te (Fot. 1) wykorzystywały kontakt między świniami zakażonymi i wrażliwymi i obejmowały monitorowanie zwierząt zakażonych i kontaktowych. Pozwoliły na przybliżone określenie wskaźników transmisji zgodnie ze strukturą kontaktów między osobnikami. Stwierdzono, że transmisja zakażenia była zmienna w czasie, ze szczytem około 15 dni po zakażeniu, i obniżając się do 49 dnia po zakażeniu. Wykorzystując podobną procedurę wykazaliśmy również istotną redukcję współczynnika transmisji w populacjach szczepionych. Końcowy model uzyskano przez połączenie modelu populacyjnego i epidemiologicznego.
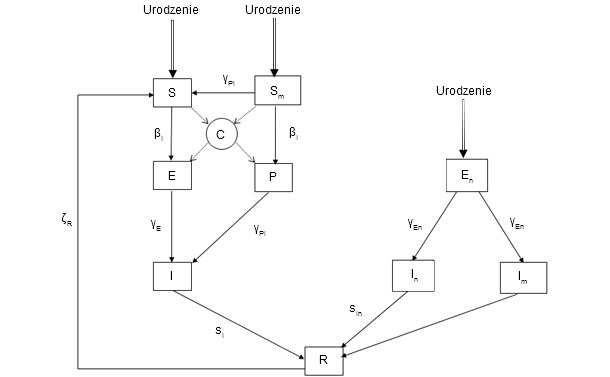
Ryc. 2. Epidemiologiczny model zakażenia PCV2. Stany zmienne: S: wrażliwy; Sm: prosięta wrażliwe przy urodzeniu posiadające odporność siarową; E: stan utajenia świń zakażonych bez odporności biernej; P: prosięta z odpornością bierną zakażone przez kontakt siewcą; I: świnie siewcy; En: prosięta zakażone w sposób pseudo-pionowy zainfekowanym nasieniem (stan utajenia); In: siejące prosięta (zakażone w sposób pseudo-pionowy) bez odporności biernej; Im: prosięta siejące (zakażone w sposób pseudo-pionowy) posiadające odporność bierną; R: „ozdrowieńcy”: świnie nie stanowiące źródła wirusa.

Doświadczenie nad parametrami transmisji PCV2
Czego nauczył nas ten model?
Wiek zakażenia PCV2, główny czynnik ryzyka PMWS, badano jako wyjściową zmienną 12 kombinacji strategii zarządzania w zakresie mieszania miotów i warunków utrzymania warchlaków. Ograniczenie mieszania prosiąt w porodówkach i warchlakarniach opóźniało proces zakażenia prowadząc do niższej liczby wczesnych infekcji. Utrzymywanie prosiąt po odsadzeniu w grupach zawierających zwierzęta tylko z jednego miotu istotnie zmniejszyło prawdopodobieństwo wczesnej infekcji. Wyniki te wykazały istnienie możliwych interakcji między zidentyfikowanymi czynnikami ryzyka PMWS.
Zależność seroprewalencji od wieku wykazano dla dwóch skrajnych strategii zarządzania, np. całkowicie liberalnej (dowolne mieszanie prosiąt z różnych miotów zarówno w porodówkach jak i warchlakarniach, duże kojce w warchlakarniach), i konserwatywnej (brak mieszania miotów, warchlaki w małych kojcach odrębnych dla każdego miotu). Wyniki te porównano do aktualnych danych seroprewalencji uzyskanych w badaniach terenowych (Ryc. 3). Spodziewana średnia seroprewalencja uzyskana w symulacji strategii liberalnej była bliska seroprewalencji w fermach z kliniczną postacią PMWS, podczas gdy profil seroprewalencji w symulacji konserwatywnej dał podobny wynik to stwierdzanego w fermach zakażonych PCV2 subklinicznie (Ryc. 3).
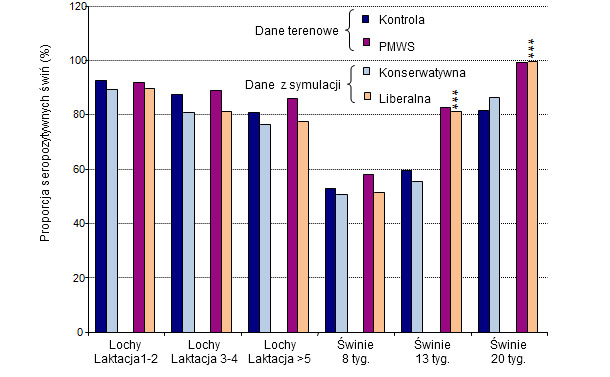
Ryc. 3. Porównanie symulacji seroprewalencji PCV2 z danymi terenowymi.
Porównując strategie szczepień, wyniki symulacji wykazały, że szczepionki dla prosiąt w znacznym stopniu ograniczyły liczbę infekcji. Sugeruje to silny efekt ochronny szczepienia prosiąt prowadzący do dramatycznego obniżenia liczby zakażeń PCV2 w sektorach warchlaków i tuczników. Wykazanie obniżenia liczby wczesnych infekcji PCV2 może wyjaśniać doniesienia o wysokiej skuteczności szczepionek przeciw PCV2 w sytuacji klinicznej postaci PCV2.
Na przykładzie PCV2 wykazano przydatność modelowania dla lepszego zrozumienia złożonej choroby wynikającej ze specyficznego przebiegu zakażenia tym wirusem. Badania modelowe mogą być niezwykle pomocne dla zrozumienia mechanizmów biologicznych, oceny różnych scenariuszy, a także dostarczać nowych tematów badawczych.



