Szacuje się, że w jelitach świń jest od 1010 do 1012 bakterii, czyli o 10 razy więcej niż ilość komórek budujących ich organizm (Luckey, 1972). Dlatego właśnie układając dawki pokarmowe dla naszych zwierząt należy pamiętać o ich ogromnym udziale w funkcjonowaniu organizmu, ponieważ dzięki zdrowszej i korzystniejszej florze bakteryjnej w jelitach świń, możemy bezpośrednio wpływać na procesy trawienne, poprawiać funkcjonowanie układu odpornościowego, a także zwiększać efektywność produkcji.
Na mikroflorę można wpływać na wiele sposobów:

Wpływ na dostępność składników odżywczych dla określonych gatunków bakterii
Ogólnie rzecz biorąc, bakterie w przedniej części okrężnicy mają dostęp do dużej ilości składników pokarmowych pochodzących z niestrawionych resztek pokarmu, ilość ta zostaje ograniczona w dalszych odcinkach przewodu pokarmowego.
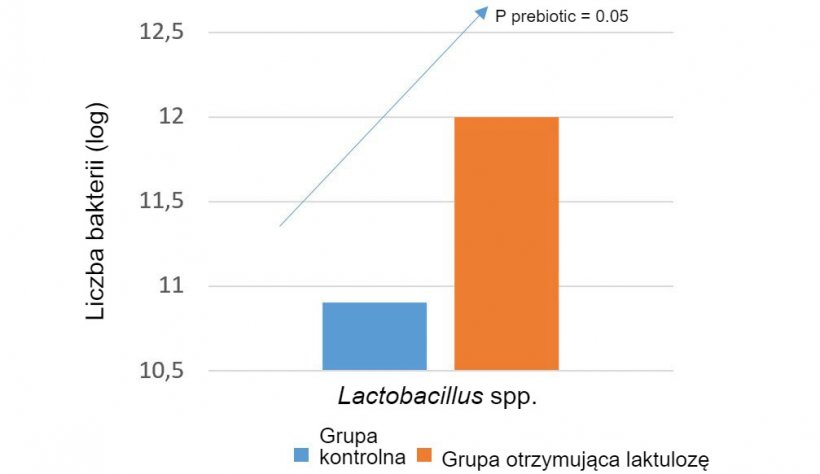
Prebiotyki można zastosować w celu zwiększenia populacji bakterii najlepiej oddziałujących na organizm zwierzęcia. Przykładowo, laktuloza zwiększa liczebność Lactobacillus spp. War et al. 2014.
Jedną z możliwości modyfikowania ilości dostępnych składników pokarmowych jest stosowanie prebiotyków. Pomysł na zastosowanie prebiotyków zapoczątkowany został po dokonaniu obserwacji, że inulina i fruktooligosacharydy (FOS) stymulują wzrost bifidobakterii, które klasyfikowane są jak korzystna flora bakteryjna (Gibson and Roberfroid, 1995). Obecnie istnieje wiele informacji w literaturze, które potwierdzają zasadność używania prebiotyków w żywieniu świń, w celu zwiększenia liczebności bakterii z rodzaju Bifidobacterium spp., Lactobacillus spp., Bacteroides spp i innych. Efekt stymulacji mikroflory można również osiągnąć po przez: zwiększenie udziału włókna fermentacyjnego w dawce pokarmowej, które nasila procesy fermentacyjne w okrężnicy; (Correa-Matos, 2003); redukcję białka w diecie, a co się z tym wiąże, uniknięcie fermentacji białek w dalszych odcinkach jelit (Pérez, 2013); włączanie enzymów egzogennych, które z polisacharydów nieskrobiowych produkują oligosacharydy o działaniu prebiotycznym (Bedford, 2004).
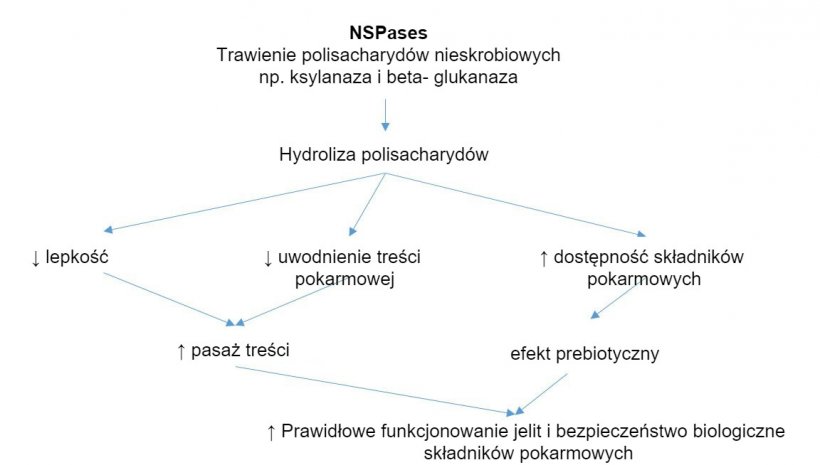
Mechanizm działania enzymów egzogennych. Enzymy egzogenne wykazują działanie prebiotyczne przez hydrolizę nieskrobiowych polisacharydów do oligosacharydów wykorzystywanych przez niektóre bakterie. Zapożyczone z Sinha 2011
Można również opracować programy żywieniowe z udziałem probiotyków, które wpłyną na modyfikację składników pokarmowych w jelicie. Umożliwia to osiągnięcie celu, jakim jest ograniczenie dostępności pewnych składników pokarmowych oraz wzrostu bakterii patogennych, a a w związku z tym, stworzenie odpowiednich warunków do wzrostu korzystnej flory bakteryjnej. Bakterie probiotyczne konkurują o pewne składniki pokarmowego z innymi bakteriami i wykorzystują je efektywniej (Gerritsen et al., 2011). Z drugiej strony program z zastosowaniem probiotyków można oprzeć na żywieniu krzyżowym- dostęp do probiotyku, który dostarcza specyficzne metabolity stymulujące wzrost najlepszych dla organizmu bakterii. Przykładem takiej praktyki są badania przeprowadzone przez Belenguer’a (2006), w przebiegu których produkowany przez bifidobakterie mleczan i octan stymulowały wzrost butyrogennej mikroflory (zapewniając energię kolonocytom).
Zmiany w środowisku światła jelit
Wpływ na profil flory jelitowej mają także zmiany w środowisku fermentacyjnym i pH. Cel ten można osiągnąć bezpośrednio dzięki substancjom zakwaszającym lub pośrednio dzięki probiotykom, np. bakterie kwasu mlekowego, które produkują kwas mlekowy jako ich główny metabolit (Yang et al., 2015). W wyniku fermentacji prebiotyków, takich jak FOS bądź inulina powstają kwasy organiczne obniżające pH w świetle jelit i zapobiegają kolonizacji bakterii z rodzaju Enterobacter i Clostridia, wrażliwych na kwaśne środowisko..
Porozumiewanie się bakterii między sobą za pomocą związków sygnałowych (Quorum Sensing)
Niezwykle obiecującym pomysłem, będącym nadal na etapie badań, jest ingerencja w mechanizm porozumiewania się bakterii między sobą (QS). Komunikowanie odbywa się za pośrednictwem związków chemicznych i pozwala na stworzenie odpowiedzi na taki sygnał w postaci aktywacji bądź hamowania ekspresji pewnych genów, co w ostateczności umożliwia skoordynowaną pracę komórek bakteryjnych, zapewniającą korzyści w zakresie przetrwania, m.in. tworzenie biofilmu czy też sporulacja (Hughes and Sperandio, 2008). Stosując pewne probiotyki, które uwalniają inne związki sygnałowe, bądź enzymy hydrolizujące związki sygnałowe, można wpływać na szlaki komunikacyjne pomiędzy bakteriami (Brown, 2011). Należy jednak podkreślić, że większość dostępnych obecnie informacji na temat mechanizmu komunikacji bakterii pochodzi z doświadczeń przeprowadzanych in-vitro. Kluczowym będzie sprawdzenie, czy wyniki przeprowadzone w warunkach in vivo są spójne, czy też zależą od czynników środowiskowych przewodu pokarmowego zwierzęcia.

Obiecującym pomysłem jest możliwość zastosowania niektórych probiotyków w celu oddziaływania na mechanizm komunikacji pomiędzy bakteriami (Quorum sensing). W ten sposób byłoby można zapobiec mechanizmom obronnym bakterii wywołanym przez niekorzystne warunki. Do takich mechanizmów należą m.in. sporulacja czy tworzenie biofilmu.
Wpływ na kolonizację i rozwój przewodu pokarmowego

Na zakończenie warto wspomnieć, że pierwsze tygodnie życia są etapem, w którym potencjalnie najlepiej wprowadzać takie strategie żywieniowe. Szansa na osiągnięcie oczekiwanych, długotrwających efektów jest największa. Z jednej strony literatura mówi, że mikroflora nowonarodzonych zwierząt jest stosunkowo dynamiczna i zdecydowanie bardziej podatna na wpływ środowiska, niż mikroflora matczyna. Z drugiej strony skład mikroflory na tym etapie determinuje jej skład w przyszłości, a fakt ten nazywany jest „imprintingiem mikroflory” (Konstantinov et al., 2006). Ponadto powszechnie wiadomo, że flora bakteryjna odgrywa zasadniczą rolę w „dojrzewaniu” przewodu pokarmowego u młodego zwierzęcia, aby rozwinął wszystkie swoje funkcje niezbędne w życiu dorosłym (Lewis et al., 2012). Uwidaczniają to badania z udziałem zwierząt wolnych od wszystkich wykrywalnych mikroorganizmów (germ-free), w przebiegu których stwierdzono, że takie zwierzęta nie mają w pełni wykształconego układu odpornościowego i niedojrzałą budowę przewodu pokarmowego (Luczynski et al., 2016). Podobne doświadczenie przeprowadzono w warunkach terenowych gdzie zwierzęta zostały narażone na kontakt z większą liczbą różnorodnych drobnoustrojów, wykazywały zdecydowanie lepszy skład mikroflory, zdolny do adaptacji w przypadku zmian w środowisku oraz większą oporność na potencjalnie niebezpieczne bakterie (Mulder et al., 2009). Podsumowując, z praktycznego punktu widzenia, najlepszym momentem na podjęcie działań, długotrwałych w skutkach, modyfikujących skład mikroflory jest pierwszy etap życia zwierzęcia, jak również etap ciąży u loch (Kenny et al., 2011).



