Objawy kliniczne PRRS mogą być bardzo zmienne i dlatego rozpoznanie kliniczne musi być potwierdzone rozpoznaniem laboratoryjnym. Najczęściej w tym celu wykorzystuje się test ELISA (do wykrywania przeciwciał) i PCR (do wykrywania materiału genetycznego wirusa).
Wybór odpowiedniej metody zależy od celu diagnostycznego. Metody o wysokiej swoistości są potrzebne przy monitoringu ferm wolnych od PRRS, podczas gdy do badania nasienia wymagane są metody o wysokiej czułości, umożliwiające wykrycie zakażenia jak najwcześniej. W programach zwalczania PRRS najkorzystniej jest łącznie stosować testy ELISA i PCR a także sekwencjonowanie i analizę DNA. W każdej fermie należy zaplanować próbobranie biorąc pod uwagę cel rozpoznania i organizację fermy. Odpowiedź na najprostsze pytanie „czy ferma jest zakażona PRRSV?” może nam dać badanie testem ELISA surowicy od 10-20 starszych tuczników. Szczegółowa analiza krążenia PRRSV w fermie o cyklu zamkniętym, lub w systemie „multi-site”, wymaga badania dużej liczby próbek reprezentujących różne grupy wiekowe i wszystkie lokalizacje gdzie przebywają świnie, ponieważ każdy budynek należy rozpatrywać jako odrębny ekosystem.

Interpretacja serokonwersji i obecności wirusa w fermach gdzie stosuje się szczepionki żywe, atenuowane jest wyjątkowo trudna ponieważ (1) szczepionki markerowe są niedostępne, (2) szczep zawarty w szczepionce może utrzymywać się w fermie i (3) przynajmniej przez pewien czas szczepy szczepionkowe i dzikie mogą koegzystować w populacji. W takich fermach pełen obraz cyrkulacji PRRSV można uzyskać jedynie w wyniku analizy sekwencji PRRSV z różnych grup wiekowych.
Serologiczne testy ELISA są łatwe w wykonaniu i cechuje je ogólnie dobra czułość i swoistość kiedy używane są do diagnostyki populacji. Surowice pojedynczych świń, szczególnie dorosłych, dają niekiedy wyniki fałszywie dodatnie. Stwarza to problem w przypadku monitoringu populacji ujemnych i wymaga powtarzania badania przy użyciu innej metody (np. IPMA czy IFA), lub innego testu ELISA o wyższej swoistości. Należy również powtórzyć badanie po 2-3 tygodniach. Problem specyficzności testów ELISA jest rzadko podnoszony w badaniach biegłości laboratoriów diagnostycznych. Wpływ niskiej czułości danego testu ELISA na diagnostykę może być zminimalizowany poprzez zwiększenie liczby badanych próbek. Niska specyficzność testu ELISA zawsze wymaga zastosowania weryfikacji wyniku przy użyciu dodatkowych narzędzi.
Można przyjąć, że każdy zestaw ELISA jest przydatny do wykrywania przeciwciał przeciwko szczepom należącym do obu genotypów PRRSV, lecz zestawy, które posiadają antygeny tylko jednego genotypu często wykazują niższą czułość w odniesieniu do serokonwersji po zakażeniu drugim genotypem. Na rynku dostępne są również zestawy służące do różnicowania serokonwersji wywołanej przez PRRSV typ 1 od serokonwersji wywołanej przez PRRSV typ 2. Ze względu na krzyżowe reakcje serologiczne między genotypami interpretacja wyników takich testów powinna być szczególnie ostrożna, i w każdym przypadku wynik wskazujący na koinfekcję fermy obydwoma genotypami PRRSV, należy to potwierdzić przy użyciu testu PCR do ich różnicowania.
Metoda PCR opiera się na wiązaniu krótkich syntetycznych oligonukleotydowych starterów do określonych fragmentów genomu, które następnie ulegają cyklicznej, enzymatycznej amplifikacji. Obecnie najczęściej produkt takiej amplifikacji jest wykrywany w wyniku pomiaru fluorescencji emitowanej przez sondę DNA po jej połączeniu się z określonym fragmentem amplifikowanego DNA. Niekiedy w końcowych cyklach PCR sondy mogą emitować fluorescencję mimo braku swoistej amplifikacji, co może być błędnie interpretowane jako wynik słabo dodatni.


Ellingson 2013, Praca doktorska, Iowa SU
Głównym problemem związanym z diagnostyką PRRSV przy pomocy PCR jest bardzo wysoka zmienność tego wirusa. Jeśli do mutacji dojdzie w obrębie miejsc wiązania się starterów i sond PCR, może to prowadzić do wyników fałszywie ujemnych. Wyniki badań porównawczych testów PCR do wykrywania PRRSV przeprowadzonych przez Laboratorium Referencyjne OIE (Podgórska et al., 2015) wskazują, że niektóre komercyjnie dostępne zestawy nie wykrywają wielu szczepów PPRSV typ 1, głównie pochodzących ze wschodniej Europy. Ze względu na niewielką dostępność sekwencji z tego regionu, większość obecnie wykorzystywanych starterów i sond opracowano na podstawie sekwencji PRRSV typ 2 i PRRSV typ 1, podtyp 1, podczas gdy to podtypy 2-4 są szczególnie zmienne (Stadejek et al. 2013). Ponadto wykazano, że niektóre szczepy należące do podtypów wschodnioeuropejskich są bardziej zjadliwe od szczepów obecnych w Europie środkowej i zachodniej, i możliwość szybkiego ich wykrywania jest szczególnie ważna w celu minimalizacji ryzyka ich niekontrolowanego rozprzestrzenienia.
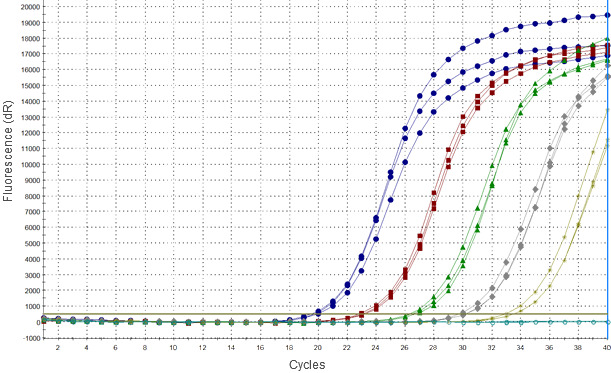
Obecnie nie można wskazać jednej, uniwersalnej metody PCR, która pozwalałaby na wykrywanie wszystkich krążących szczepów PRRSV z optymalną czułością. Wynika z tego konieczność oceny obecnie używanych metod i ich ciągła walidacja z wykorzystaniem aktualnie krążących szczepów wirusa. W tym celu należy stworzyć kolekcję szczepów PRRSV reprezentujących jak najszerszy zmienności, co obecnie jest jednym z najważniejszych zadań laboratoriów referencyjnych PRRS.








