Wykorzystanie łańcuchowej reakcji polimerazy (PCR) jest jednym z najbardziej powszechnych narzędzi diagnostycznych stosowanych obecnie w medycynie świń. Jest ona wykorzystywana nie tylko do celów diagnostycznych, ale także jako środek poprawy bezpieczeństwa biologicznego poprzez nadzór i monitorowanie chorób. W związku z tym, przy interpretacji wyników bardzo ważne jest zrozumienie zalet i wad tej technologii. Należy również pamiętać, że chociaż ta sama technologia jest stosowana w odniesieniu do różnych patogenów, powinny istnieć różnice w sposobie interpretacji wyników.
Informacje dotyczące testu
Test PCR jest przeznaczony do wykrywania materiału genetycznego (DNA lub RNA) bakterii lub wirusów. Proces rozpoczyna się od ekstrakcji DNA lub RNA z próbki, która następnie jest poddawana termicznym cyklom amplifikacji (zwiększania ilości materiału genetycznego w próbce). Jeżeli materiałem docelowym jest RNA, pierwszym krokiem jest przekształcenie RNA w DNA (technicznie określane jako cDNA). Cykle termiczne mają na celu utworzenie 3-etapowego procesu 1) denaturacji, 2) annealingu (przyłączanie starterów) i 3) wydłużenia (elongacji), którego wynikiem jest powielenie materiału DNA obecnego w próbce. Tak więc na każdy cykl (1 Ct), przy założeniu 100% skuteczności, przypada dwukrotna obecność DNA. Celem jest kontynuowanie procesu amplifikacji do momentu wykrycia w próbce wystarczającej ilości DNA do uzyskania pozytywnego wyniku testu lub do 30-40 cykli, w zależności od konstrukcji stosowanego testu.

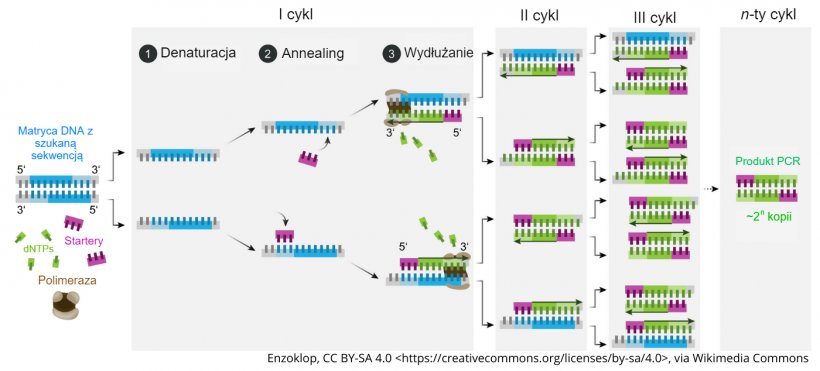
Proces ekstrakcji jest krytycznym etapem testu PCR, ponieważ wpływa na ilość i jakość materiału genetycznego w badanej próbce. Kluczowe znaczenie ma zastosowanie odpowiedniego procesu ekstrakcji dla rodzaju badanej próbki (surowica, płyny ustne, tkanka itp.). Etap 2 procesu amplifikacji (proces annealingu) wymaga użycia starterów, które są krótkimi fragmentami sekwencji DNA, zaprojektowanymi specjalnie w celu przyłączenia i pomocy w replikacji specyficznej sekwencji genetycznej danego patogenu. W przypadku patogenów, które stale ewoluują genetycznie (jak np. wirus PRRS), startery te muszą być okresowo aktualizowane, aby zapewnić wykrywanie nowych szczepów.
Wartość graniczna cyklu badania (zwykle około 30-40 Ct) jest ustalana przy założeniu, że jeżeli proces amplifikacji będzie kontynuowany, to w końcu wynik badania będzie dodatni, po prostu z powodu spontanicznego annealingu i elongacji, które zaczną mieć miejsce. Sugeruje to, że słabododatnie wyniki, wysokie wartości Ct bliskie granicy odcięcia, wymagają szczególnej uwagi przy interpretacji wyników, zwłaszcza pod koniec epidemii.
W medycynie świń stosowane są dwa różne testy PCR. Tradycyjny PCR w żelu i bardziej nowoczesny PCR w czasie rzeczywistym (real-time PCR). Oba testy działają tak samo, opierając się na amplifikacji DNA lub RNA. Różnica polega na tym, że test żelowy jest "odczytywany" tylko raz na koniec badania, natomiast w przypadku PCR w czasie rzeczywistym wyniki badania są "odczytywane" po każdym cyklu. Zaletą reakcji PCR w czasie rzeczywistym jest to, że umożliwia ona uzyskanie wyników ilościowych/półilościowych.
Łączenie próbek do badań
Testy PCR mają dużą zdolność do wykrywania małych ilości materiału genetycznego w próbkach (czułość analityczna) ze względu na proces amplifikacji materiału genetycznego w próbce. Daje to możliwość oceny wielu próbek w jednym badaniu (poprzez łączenie próbek). Należy pamiętać, że łączenie z definicji powoduje rozcieńczenie badanej próbki. Nie powinno to stanowić problemu, gdy spodziewane stężenie danego patogenu jest wysokie (zwłaszcza na wczesnym etapie wybuchu choroby). Łączenie może stanowić problem, gdy stężenie patogenu w próbce dodatniej jest niskie, np. pod koniec ogniska choroby lub w przypadku próbek, co do których można się spodziewać, że są już próbką zbiorczą (płyny ustne).








