Integralność nabłonka oraz wydzielanie śluzu są pierwszą fizyczną linią obrony przeciwko antygenom, toksynom oraz mikroorganizmom. Ponadto, nabłonek oraz komórki układu odpornościowego w odpowiedzi na kontakt z patogenem wydzielają proteiny przeciwbakteryjne (AMPs).
Najważniejszą linią obrony przeciwko patogenom są komórki odporności wrodzonej oraz nabytej związane z powierzchnią. Są one zorganizowane zarówno w zdefiniowane struktury, zwane Tkanką Limfatyczną Związaną z Błoną Śluzową (MALT), takie jak: Tkanka Limfatyczna Przewodu Pokarmowego (GALT), Tkanka Limfatyczna Oskrzeli (BALT), Tkanka Limfatyczna Nosa i Gardła (NALT) itp., oraz tkankę limfatyczną w formie rozsianej w nabłonku i błonie podstawnej.

Ekspresja Receptorów Rozpoznających Antygeny (PRR) głównie rec. TLR oraz NOD- podobnych (ang. NLRs), w nabłonku oraz na komórkach układu odpornościowego moduluje rozpoznawanie oraz stopień nasilenia reakcji zapalnej / odpowiedzi immunologicznej przeciwko mikroorganizmom.
Odporność błony śluzowej przewodu pokarmowego rozwija się od urodzenia, w powiązaniu z kolonizacją jelit przez mikrobiotę. Jest ona niezbędna do procesu dojrzewania immunologicznego i rozwoju GALT, wpływając na występowanie subpopulacji limfocytów efektorowych i limfocytów B biorących udział w wytwarzaniu IgA. Różne subpopulacje limfocytów CD4, CD8 i γδT oraz komórki odporności wrodzonej są zlokalizowane w blaszce podstawnej oraz nabłonku. (Rys 1).
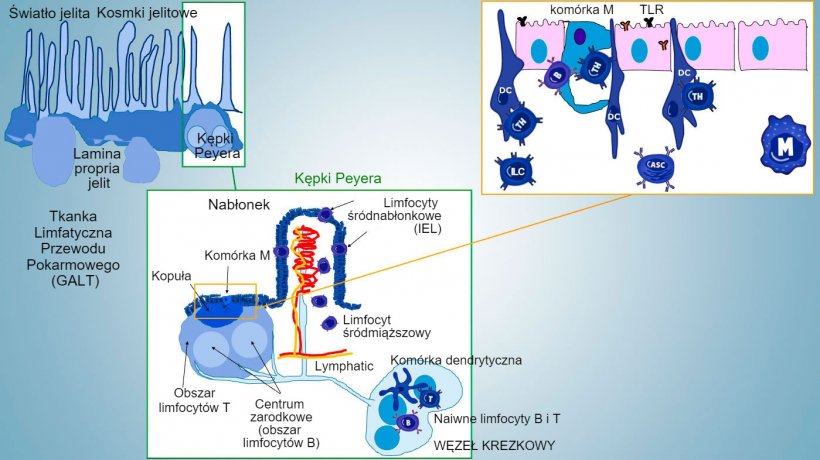
Rys 1: Schematyczne przedstawienie tkanek limfoidalnych związanych z jelitem: kępka Peyera (PPs), izolowane grudki chłonne i krezkowe węzły chłonne.
Najważniejszymi typami limfocytów T-pomocniczych w tkance jelit są limfocyty T regulatorowe (Treg), Th1, Th2 i Th17. Limfocyty odporności wrodzonej (ILCs) odgrywają również kluczową rolę w odpowiedziach immunologicznych na powierzchni błon, wchodząc w interakcję z innymi komórkami odporności wrodzonej jak i nabytej- głównie z Th17.
Ponadto, mikroflora jelitowa, hamuje kolonizację i wzrost patogenów, poprzez przekazywanie sygnałów zapoczątkowujących wrodzone mechanizmy, np. wydzielanie białek przeciwdrobnoustrojowych.
W płucach, komórki cytotoksyczne CD4 Th1 i CD8 występują jako komórki efektorowe przeciwko patogenom wewnątrzkomórkowym. Występują także inne typy komórek np. Th2, Th17, Treg i TFh
Odporność błon śluzowych jest w stanie rozróżnić mikroorganizmy komensalne, antygeny pokarmowe, pochodzenia aerogennego oraz pierwotne patogeny.
Antygeny pochodzenia aerogennego, antygeny pokarmowe oraz flora komensalna na ogół nie stymulują odpowiedzi zapalnej / odpornościowej, ale indukują powstawanie tolerancji immunologicznej (Rys. 2).
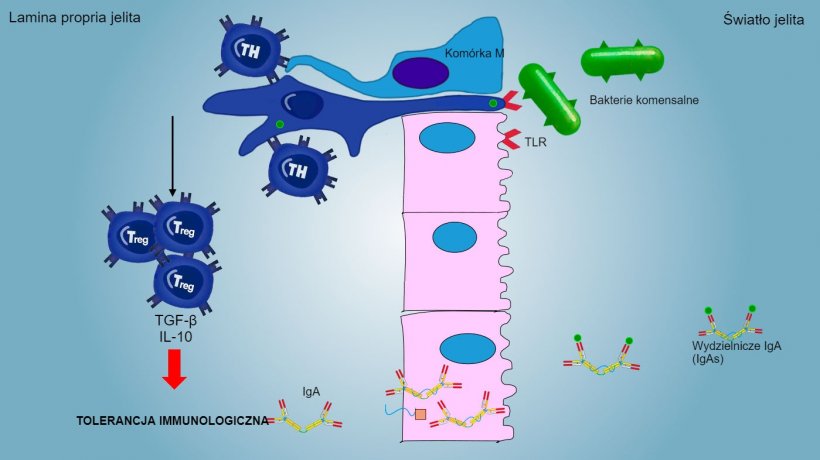
Rys. 2: Tolerancja immunologiczna bakterii komensalnych. W procesie pośredniczą limfocyty Treg z wytwarzaniem cytokin, takich jak IL-10 i TGFβ. W szczególności w jelitach wydzielanie swoistych IgA blokuje przyleganie bakterii komensalnych, tak więc dochodzi do modulowania składu mikrobioty i zapobieganiu jej ew rozsiania wieloukładowego.
Funkcjonalnie, odpowiedzi immunologiczne na powierzchniach błon śluzowych są rozróżniane ze względu na miejsce indukcji oraz działania:
- Miejsca indukcyjne: PP, izolowane grudki limfatyczne (ILF), NALT, BALT, krezkowe węzły chłonne (MLN). Podział antygenów i aktywacja odpowiedzi immunologicznej.
- Miejsca efektorowe: warstwa podstawna błony śluzowej jelita, górnych dróg oddechowych, układu moczowo-płciowego, gruczołu mlekowego i ślinowego. Wywołanie odpowiedzi z zaangażowaniem zarówno zapalnych/wrodzonych, jak i swoistych mechanizmów.
W miejscach indukcyjnych, antygeny są wychwytywane przez komórki mikrokolumnowe (M), które transportują i uwalniają antygeny do przestrzeni zewnątrzkomórkowej, gdzie są wychwytywane i przetwarzane przez znajdujące się tam komórki dendrytyczne; DC w blaszce podstawnej może również bezpośrednio wychwytywać antygen za pomocą reakcji cytoplazmatycznych pomiędzy enterocytami.
W PP prezentacja antygenu limfocytom T-pomocniczym stymuluje limfocyty B do zmiany klas w kierunku produkcji i sekrecji IgA w blaszce podstawnej i świetle jelita- mechanizm efektorowy defensywny (Rys 3). Alternatywnie, obarczone antygenami jelitowe DC migrują do krezkowego węzła limfatycznego indukując późniejszą ekspresję limfocytów T i B specyficznych wobec antygenu; następuje migracja aktywowanych limfocytów B, co zapewnia lokalną produkcję IgA, a także reakcję nawet na powierzchni oddalonej błony śluzowej (Rys 4).
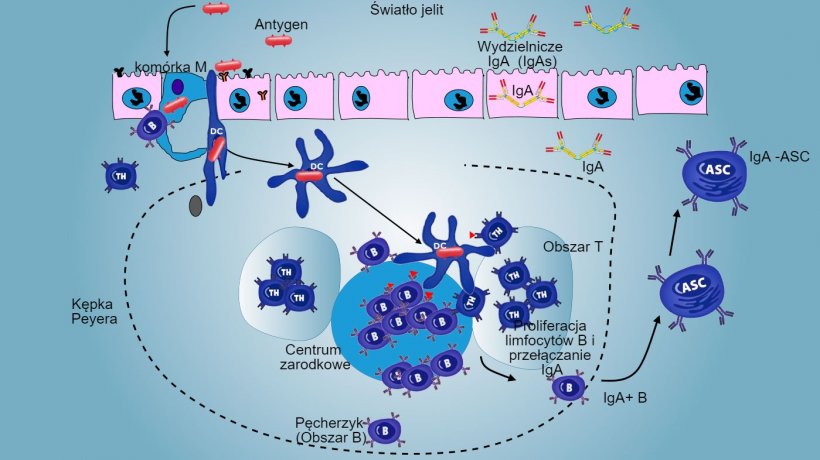
Rys 3: Wytwarzanie przeciwciał IgA w kępkach Peyera.

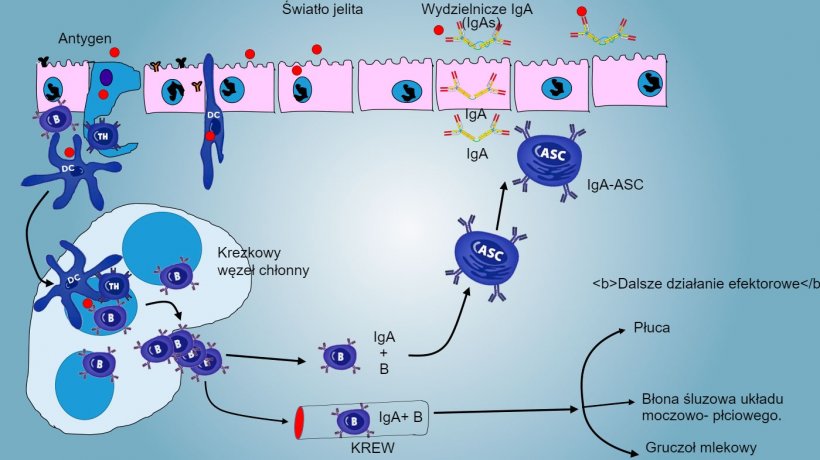
Rys. 4: Wytwarzanie IgA w krezkowych węzłach chłonnych i odpowiedź ogólnoustrojowa. Proliferujące i aktywowane limfocyty B i T migrują z limfy do krwi, u świni bezpośrednio przez HEV, większość z nich powraca do jelita lub dociera do innych powierzchni błony śluzowej (miejsca efektorowe), takich jak płuca, gruczoł mlekowy i układ moczowo-płciowy
Podobnie, przez przeniesienie komórek z dala od tkanki limfatycznej oskrzeli została wykazana zdolność immunizacji przez błonę śluzową nosa do przekazywania odpowiedzi immunologicznej, zarówno lokalnie, jak i na odległość.
W miejscach efektorowych odpowiedź immunologiczna zmienia się w zależności od patogenu, z którym następuje kontakt (Rys. 5).
W przypadku wewnątrzkomórkowego zakażenia patogenem, odpowiedź zapalna, w której pośredniczą rec. TLR i NOD, zachodzi wraz z kolejną aktywacją odpowiedzi immunologicznej zależnej od Thl, aktywacji komórek NK i cytotoksycznych limfocytów T zdolnych do zabijania i niszczenia zainfekowanych komórek; ta odpowiedź może być połączona z efektywną aktywacją kom B i wydzielaniem przeciwciał powierzchniowych.
Limfocyty γδT IE są zaangażowane we wczesną eliminację zakażonych komórek, w wydzielaniu AMP, jak również w utrzymaniu równowagi wewnętrznej jelita.
Odpowiedź, w której pośredniczą Th17 obecne w dużej ilości w blaszce podstawnej jelita, odgrywa kluczową rolę w ochronie błon śluzowych głównie przed bakteriami zewnątrzkomórkowymi, bakteriami, grzybami, ale także przed wirusami. Podczas odpowiedzi zapalnej, limfocyty Th17 aktywowane przez IL-23, wydzielają IL-17 i IL-22- cytokiny stymulujące wytwarzanie peptydów przeciwbakteryjnych oraz rekrutację i aktywację zapalnych granulocytów obojętnochłonnych (Rys 5).
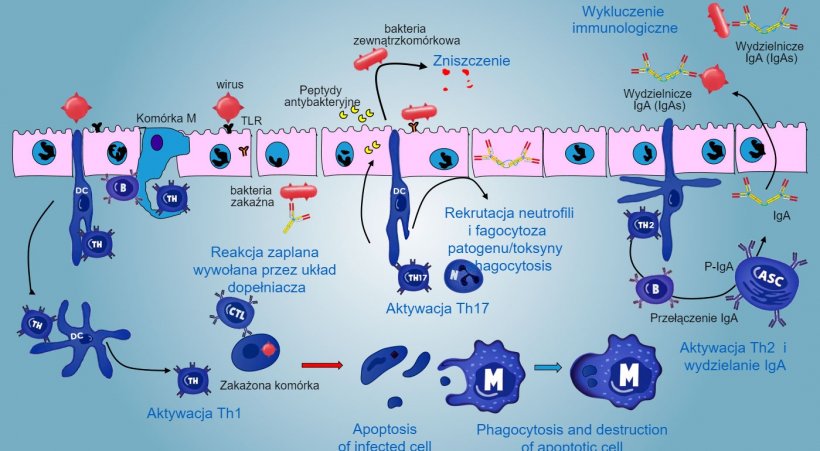
Figure 5. Ogólny obraz odpowiedzi immunologicznej błon śluzowych przeciwko patogenom.
W płucach ochrona przed patogenami obejmuje produkcję zapalnych cytokin (TNFα, IL-1β i MIP-1α i MIP-1β) oraz rekrutację neutrofili, makrofagów i limfocytów, takich jak limfocyty T CD4, limfocyty T CD8 i limfocyty γδT.
Wytwarzanie i wydzielanie przeciwciał IgA jest głównym mechanizmem odporności śluzówkowej (Rys. 6).
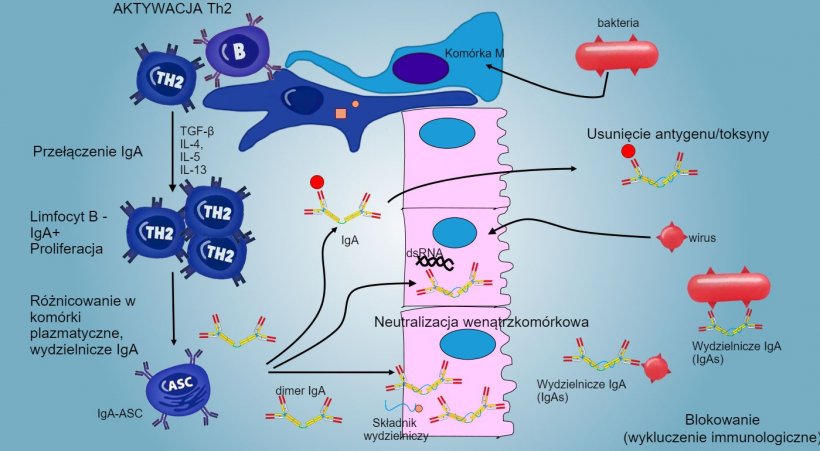
Rys. 6: "Przełączanie" w kierunku IgA jest głównie regulowane przez aktywację limfocytów Th2 z wytwarzaniem cytokin TGF-β, IL-4, IL-5, IL-13. Wydzielany dimer IgA wiąże się z receptorem (pIgR) na podstawnej powierzchni komórek nabłonkowych. Kompleks jest przetwarzany w komórce i przed migracją przez powierzchnię światła receptor ulega rozszczepieniu, a IgA pozostają związane z resztą receptora (składnik wydzielniczy)
IgA przeważają we wszystkich powierzchniowych i śluzówkowych wydzielinach; ciągłe wydzielanie IgA zachodzi w przypadku komórek plazmatycznych obecnych w tkance limfatycznej oraz błonie śluzowej.
W jelitowych PP, aktywacja limfocytów B pobudza komórki plazmatyczne do wydzielania IgA. IgA są głównie wydzielane jako dimery IgA, w których dwa monomery są połączone łańcuchem J oraz połączone ze składnikiem sekrecyjnym, który chroni s-IgA przed działaniem enzymów proteolitycznych jelit. IgA zapobiegają przyleganiu wirusów i bakterii do komórek nabłonka (mechanizm immuno-wykluczenia); są zdolne do wiązania białek wirusowych w komórce i blokowania replikacji (neutralizacji wewnątrzkomórkowej); jak również wiązania antygenów penetrujących błony śluzowe i transportu ich przez nabłonek, w celu ich eliminacji (usunięcie antygenu)
Przełączanie" w kierunku IgA jest głównie regulowane przez aktywację limfocytów Th2 z wytwarzaniem cytokin TGF-β, IL-4, IL-5, IL-13. Wydzielany dimer IgA wiąże się z receptorem (pIgR) na podstawnej powierzchni komórek nabłonkowych. Kompleks jest przetwarzany w komórce i przed migracją przez powierzchnię światła receptor ulega rozszczepieniu, a IgA pozostają związane z resztą receptora (składnik wydzielniczy)
W drogach oddechowych,, IgA dominuje w bliższych odcinkach(jamach nosowych, gardle, krtani, tchawicy, oskrzelach), podczas gdy w dalszych odcinkach (oskrzela i pęcherzyki płucne) występuje głównie ogólnoustrojowa odpowiedź immunologiczna z udziałem węzłów chłonnych i dominującego wydzielania IgG.






