Wrodzona odporność jest oparta o obecność protein powierzchniowych i wewnątrzkomórkowych zlokalizowanych na komórkach śródbłonka, neutrofili, makrofagów, komórkach dendrytycznych oraz na receptorach obecnych w cytoplazmie. Wszystkie te receptory mają zbiorczą nazwę PRRs (ang. Pattern Recognition Receptors) i łączą się z cząsteczką PAMPs (ang. Pathogen-Associated Molecular Patterns) podlegają ekspresji w wyniku kontaktu z patogenem (liposacharyd, węglowodory lub lipoproteiny bakteryjne, peptydoglikany, RNA, DNA itp.) jak i z florą komensalną.

Rozpoznanie patogenu: mechanizmy odporności wrodzonej
TLR (Toll-like receptors). U świń zidentyfikowano 10 różnych rodzajów. Posiadają zdolność do rozpoznawania bakteryjnych produktów przemiany materii na zewnątrz komórki oraz rozpoznają wirusowy kwas nukleinowy wewnątrz komórki. Niektóre receptory TLR są zlokalizowane w przestrzeni wewnątrzkomórkowej w celu rozpoznawania bakteryjnych oraz wirusowych kwasów nukleinowych. Pozostałe receptory TLR są zlokalizowane na powierzchni komórek w celu rozpoznawania cząstek bakteryjnych (lipoproteiny, peptydoglikany, lipopolisacharydy).
Receptory RLR ( RIG1-like receptors) są umiejscowione w cytoplazmie i mają zdolność rozpoznawania wirusowego dsRNA.
Białka NOD (Nucleotide-binding oligomerization domain) należą do grupy PRR umiejscowionych w cytoplazmie i wspólnie z receptorami TLR biorą udział w rozpoznawaniu cząstek bakteryjnych.
CLR (C type-lectin receptors) są powierzchniowymi receptorami, do których zaliczamy kolektyny, pentraksyny, selektyny, dektyny oraz receptor dla mannozy.
Proteiny należące do układu dopełniacza oraz białka ostrej fazy zapalenia są zdolne do działania w cytosolu i rozpoznawania antygenów: fragment C3, Czynnik Wiążący Mannozę (MBP), surfaktant, Proteina C-reaktywna (CRP).
Wzajemna aktywacja komórek rozmieszczonych w różnych obszarach tkanki, komórek epithelium i endotelium, zwłaszcza komórek prozapalnych jest pierwszą fizyczną i funkcjonalną barierą przeciw patogenom zapoczątkowującą reakcję zapalną.
Tabela 1: System rozpoznawania patogenu przez odporność wrodzoną.
| RECEPTOR | ROZPOZNAWANA AKTYWNOŚĆ | ||
| TLR (błona lub śródplazmatycznie) | Rozpoznawanie produktów bakteryjnych oraz grzybów | TLR1 | Lipopeptydy (bakterie i mykoplazmy) |
| TLR2 | Lipoproteiny and proteoglikany (gram+) Lipopeptydy (mykoplazmy) LPS (Leptospira) Lipoarabinomannan (mykobakterie) Lipopeptydy (mykoplazmy) (gram+) Zimosan (grzyby) |
||
| TLR4 | LPS (gram-) F-proteina RSV HSP60 (Chlamydia) |
||
| TLR5 | Flagellina (wiele bakterii) | ||
| TLR6 | Lipopeptydy (mykoplazmy) Lipopeptydy (mykoplazmy) (gram-) Zimosan (grzyby) |
||
| TLR9 | CpG DNA bakteryjny | ||
| TLR10 | Nieznane | ||
| Rozpoznawanie białek wirusowych | TLR3 | dsRNA | |
| TLR7 TLR8 |
ssRNA. | ||
| TLR9 | CpG DNA wirusa | ||
|
CLR |
Selektny, dektyny 1,2 |
Rozpoznaje węglowodorową domenę na patogenie i indukuje fagocytozę lub ma działa prozapalne poprzez produkcję cytokin- odpowiedź immunologiczna Th1 lub Th17 | |
|
RLRs |
RIG-1  |
Wiąże ssRNA w trakcie replikacji wirusowego RNA, indukuje produkcję cytokin prozapalnych oraz IFN typu I, działa przeciwwirusowo. | |
| proteina NOD (cytoplazma) | NOD1 NOD2 |
Interakcje z fragmentami bakteryjnymi poprzez swoiste struktury. NOD u świń podlegają silnej ekspresji w węzłach chłonnych krezkowych i w tkance limfatycznej przewodu pokarmowego (GALT), pełniąc ważną rolę w odporności przeciwko infekcjom bakteryjnym. | |
|
APP (Białka Ostrej Fazy) |
Proteina C-reaktywna (CRP) | Produkowane w wątrobie, mają zdolność do wiązania Fosfatydylocholiny będącej pozostałością po ścianie komórkowej niektórych bakterii i grzybów. Biorą udzial w klasycznej drodze aktywacji układu dopełniacza oraz zwiększają zdolność makrofagów do fagocytozy (fagoctyoza za pośrednictwem opsonin). | |
| Lektyna wiążąca mannozę | Jest kolektyną z domeną lektynową zdolną do wiązania cukrów zawierających mannozę- stąd zdolność do rozpoznawania wielu wirusów, bakterii, grzybów oraz pierwotniaków. MBL ma także zdolność do aktywacji układu dopełniacza drogą klasyczną jak i alternatywną co umożliwia fagocytozę za pośrednictwem opsonin. |
Rozpoznawanie patogenu: mechanizm odporności nabytej
Specyficzne komórki B oraz T posiadają receptory zdolne do rozpoznawania determinant antygenowych (epitopów) określonych patogenów
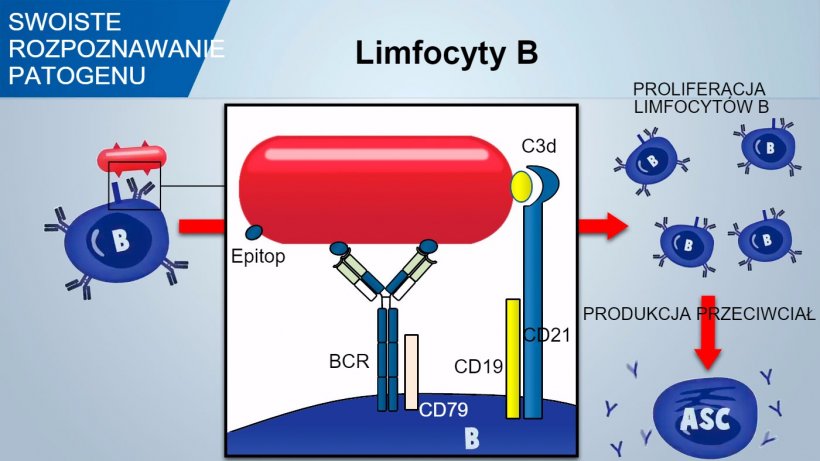
Limfocyty B posiadają na swojej powierzchni receptor zwany BCR (B cell Receptor) składający się z powierzchniowej immunoglobuliny, IgM lub IgD, specyficznej tylko dla danego antygenu. W trakcie kształtowania limfocytów B w szpiku kostnym dochodzi do powstawania całej palety rodzajów receptorów BCR, co w konsekwencji powoduje powstanie wielu limfocytów B, których zadaniem jej rozpoznawanie olbrzymiej ilości specyficznych dla siebie antygenów.
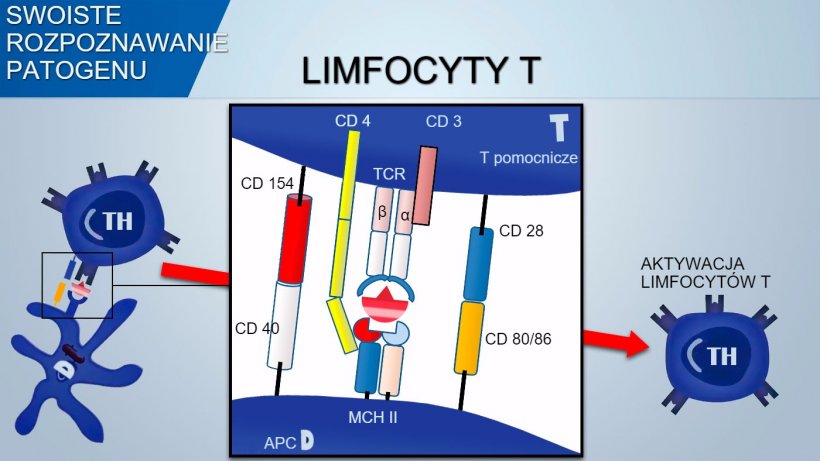
Receptor komórek T (TCR) zlokalizowany na komórkach T pomocniczych oraz limfocytach T cytotoksycznych składa się z dwóch łańcuchów α oraz β. Rec TCR zlokalizowany na limfocytach γδT składa się natomiast z dwóch łańcuchów, δ oraz γ. Dzięki podobnym mechanizmom rozpoznawania antygenów na receptorach TCR jest możliwe rozpoznawanie szerokiego spektrum różnych antygenów na limfocytach T.
Limfocyty B rozpoznają determinantę antygenową patogenu i sygnał jest przekazywany do wnętrza komórki poprzez aktywację pokrewnej glikoproteiny (CD79α/β). Po utworzeniu kompleksu BCR-antygen, dochodzi do przetworzenia antygenu i wraz z kompleksem MHC II jego prezentacja na powierzchni limfocytu B dla limfocytów T pomocniczych. Wzajemna stymulacja pomiędzy limfocytem B oraz T jest kluczowa dla aktywacji limfocytów B i rozpoczęcia formowania przeciwciała. Aby reakcja przebiegała w sposób efektywny wymagany jest mediator w postaci kompleksu CD21/CD19, który rozpoznaje fragment (C3d) zlokalizowany na patogenie.
Odwrotnie, limfocyty T rozpoznają przetworzoną determinantę antygenową prezentowaną przez APC w połączeniu z MHC (Major Histocompatibility Complex).
MHC II są cząsteczkami, które zazwyczaj są obecne na powierzchni komórek APC, takich jak dojrzałe komórki dendrytyczne, aktywowane w wyniku zapalenia makrofagi oraz aktywowane limfocyty B. MHC I z kolei biorą udział w prezentowaniu endogennych antygenów dla limfocytów T cytotoksycznych.
Układ MHC świń znany jest jako SLA (ang. Swine Leukocyte Antigen) i tworzy go 70 genów podzielonych na 3 klasy:
U świń, geny MHC (SLA: “Swine Leukocyte Antigen”) są zlokalizowane w obszarze centromeru chromosomu nr 7. Opisane po raz pierwszy w roku 1970, siedemdziesiąt genów (haplotypów) podzielono na 3 klasy:
- SLA I odpowiedzialne za kodowanie cząsteczek MHC I zlokalizowanych na większości komórek zawierających jądro- poza neuronami i trofoblastami. Cząsteczki MHC są powiązane i biorą udział w prezentowaniu antygenów śródcytoplazmatycznie (np. antygeny wirusowe) dla limfocytów T CD8+. Cząsteczka MHC I składa się z jednego ciężkiego łańcucha α (wysoce polimorficzny) oraz dwóch łańcuchów lekkich β2 zwanych β2-mikroglobuliną.
- SLA II: cząsteczki MHC klasy II podlegają ekspresji na powierzchni limfocytów B i niektórych populacjach limfocytów T, w zależności od stopnia ich aktywacji. Cząsteczki MHC II są powiązane z przetworzonymi antygenami (fagocytoza i degradacja to pojedyńczych peptydów) wewnątrz komórek układu APC. Cząsteczka MHC II składa się z łańcuchów α oraz β.
- SLA III są odpowiedzialne za kodowanie genetyczne układu dopełniacza, cytokin itp.
Do aktywacji limfocytu Th wymagane jest, by sygnał przekazywany przez receptor TCR kompleksu antygen-MHC był powiązany z sygnałem, w którym pośredniczy wiązanie powierzchniowe molekuł kostymulujących: CD28(na limfoctach T) wiążąca się z CD80 (na APC) lub CD86(na limfocytach B), CD40 ( na APC), które wiążą się z CD154 (na limfocytach T). Taka kostymulacja zwiększa produkcję cytokin odpowiedzialnych za proliferację limfocytów T (IL-2) oraz różnicowanie limfocytów Th.






