Mimo dostępności i stosowania szczepionek przeciw grypie A (IAV) u świń, choroba ta stale przynosi straty ekonomiczne w produkcji świń. Szczepionki dla świń zwykle oparte są na pełnym inaktywowanym wirus (WIV), zawierają adjuwant (olej w wodzie) i służą do podawania domięśniowego. W USA dostępna jest szczepionka rekombinowana oparta na nie replikującym RNA alfawirusa zawierającym gen HA wirusa grypy. Fermy mają do dyspozycji również autoszczepionki. Zwykle szczepienie prowadzone jest u loch i jego celem jest przekazanie odporności biernej prosiętom. Niekiedy szczepieni stosuje się również u warchlaków lb tuczników. Mimo, że na rynku dostępnych jest wiele szczepionek dla świń to ich skład nie jest uaktualniany, co biorąc pod uwagę szybkość ewolucji wirusa, może prowadzić do niewystarczającej ochrony przed antygenowo różnymi szczepami.
W celu uzyskania licencji na stosowanie szczepionki konieczne jest wykazanie jej nieszkodliwości i skuteczności. Skuteczność szczepionki przeciw grypie może być wykazana w teście zahamowania hemaglutynacji (HI) i/lub poprzez redukcję mian wirusa w płucach szczepionych i świń zakażanych szczepem homologicznym. Czas potrzebny na uaktualnienie składu zarejestrowanej szczepionki jest różny w różnych krajach, lecz zawsze utrudnia podążanie za szybko ewoluujących wirusem. Ostatnie zmiany administracyjne wdrożone przez Center for Veterinary Biologics Departament Rolnictwa USA mogą to ułatwić.

Skuteczność szczepionki w warunkach terenowych powinna być rozpatrywana odrębnie w każdym stadzie, biorąc pod uwagę pożądany efekt. Złotym standardem charakterystyki antygenowej jest test HI i ocena poziomu przeciwciał neutralizujących jest zwykle skorelowana z poziomem odporności. Miano przeciwciał 40 lub więcej jest uważane za ochronne. Niestety miana przeciwciał określane w teście HI nie zawsze są skorelowane ze skutecznością szczepienia i wartością ochronną szczepionki. Obserwuje się to nawet w przypadku homologicznych szczepów jeśli przy szczepieniu występują niekorzystne czynniki.
Procedury rejestracji szczepionek są pracochłonne, długotrwałe i kosztowne. Idealnie byłoby aby szczepionki dla świń podlegały podobnej procedurze jak szczepionki dla ludzi przeciw grypie sezonowej, które są regularnie uaktualniane na podstawie wyników badań monitoringowych i identyfikacji nowych, antygenowo odmiennych szczepów (Ryc. 1). Dodatkowym wyzwaniem jest fakt, że ewolucja szczepów IAV u świń przebiega bardziej dynamicznie niż u człowieka. Ponadto obserwuje się istotne zróżnicowanie między regionami geograficznymi, a także wspólne krążenie wielu różnych szczepów w danym regionie (Vincent et al., 2014).
Badania monitoringowe krążących szczepów IAV stanowią podstawę podejmowania decyzji odnośnie szczepień (Ryc. 1). Analiza dostępnych sekwencji nukleotydowych szczepów od świń, i znanych pozycji antygenowych w sekwencjach aminokwasowych HA, są pierwszym etapem opracowywania zaktualizowane programu szczepień. Niestety podobieństwo aminokwasowe nie zawsze świadczy o krzyżowym zabezpieczeniu. Główne zmiany antygenowe szczepów H3 są związane z sześcioma pozycjami aminokwasowymi w pobliżu miejsca receptorowego HA, i nawet zmiana jednego aminokwasu może mieć duży wpływ na antygenowość (Lewis et al., 2014). Świńskie szczepy H1 charakteryzuje bardziej złożona zmienność, prawdopodobnie w wyniku ewolucji klasycznych szczepów i długotrwałego pasażowania szczepów ludzkich na świniach. W efekcie zmiany antygenowe nie są przypisywane mutacjom pojedynczych aminokwasów w HA szczepów H1, mimo, że podstawienia w sąsiedztwie miejsca receptorowego mają kumulacyjne efekt w określaniu antygenowości. Charakterystyka antygenowa szczepów łącznie z analizą sekwencji i analizą epidemiologiczną powinna być kluczowym elementem stosowanym w procesie decyzyjnym odnośnie stosowania szczepionki (Ryc. 1).
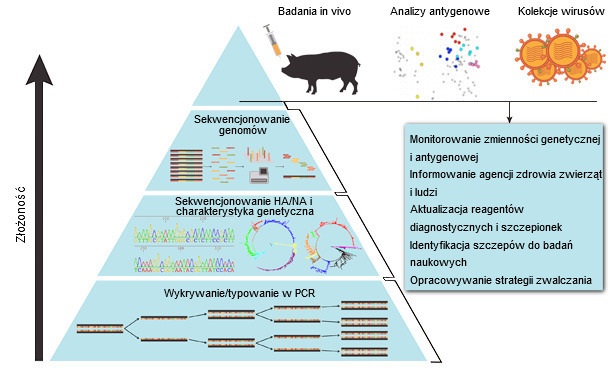
Ryc. 1. Systematyczne podejście do monitoringu wirusa grypy A u świń (na podstawie Ampofo et al., 2015).
Idealnie odpowiedź odpornościowa na szczepienie szczepionką inaktywowana powinna być wystarczająca dla redukcji objawów klinicznych i zawartości wirusa w płucach po infekcji, jeśli wirus zakażający jest antygenowo podobny do szczepionkowego. Niestety szczepionki inaktywowane często nie blokują zakażenia. Poszczepienne przeciwciała siarowe mogą zabezpieczać prosięta przed wystąpieniem objawów klinicznych, lecz nie przed zakażeniem, i mogą być wykrywane nawet do 14 tygodnia życia (Loeffen et al., 2003). Ich negatywny wpływ polega na tym, że mogą interferować z odpowiedzią na szczepienie u prosiąt. Każda odporność, bierna czy czynna, może wpływać negatywnie na odpowiedź na szczepienie szczepionką inaktywowaną.
Przeciwciała indukowane szczepionką inaktywowaną, lub bierne, nie są w stanie całkowicie zabezpieczyć przed zakażeniem innym szczepem, co jest odbierane jako nieskuteczność szczepionki i powoduje dodatkowe straty hodowcy. Nieskuteczność szczepionki może być dalej komplikowana jeśli szczepienie indukuje przeciwciała krzyżowo reagujące z HA tego samego podtypu, które nie neutralizują innego szczepu (reagujące ujemnie w teście HI), co prowadzi do zjawiska noszącego nazwę „związanego ze szczepionką zaostrzenia choroby układu oddechowego” (vaccine-associated enhanced respiratory disease – VAERD (Gauger et al., 2011). Wystąpienie VAERD jest możliwe w przypadku różnic w HA i NA między wirusem szczepionkowym a wirusem zakażającym (dzikim). Zjawisko to opisano w wielu eksperymentach i wiele wskazuje na to, że występuje ono również w warunkach terenowych.
Ograniczenie szczepionek inaktywowanych w indukowaniu odporności krzyżowej przeciw wirusom odmiennym antygenowo podkreślają potrzebę opracowania szczepionek o szerszym spektrum ochronnym. Opracowano wiele szczepionek przeciw grypie świń i wszystkie posiadają zarówno wady jak i zalety (Ryc. 2). Żywe atenuowane szczepionki przeciw grypie (LAIV) w warunkach eksperymentalnych okazywały się być bezpieczne i bardziej skuteczne od inaktywowanych w zabezpieczaniu przed heterologicznymi szczepami (Ryc. 2), ograniczając siewstwo, transmisję i interferencję z przeciwciałami siarowymi (Pena et al., 2011; Vincent et al., 2012). Szczepionki podjednostkowe i wektorowe oparte na HA i NA również okazały się być skuteczne w ochronie przed zakażeniem. Ich zaletą jest dodatkowo łatwość w ich adaptacji do ochrony przed nowymi szczepami (Wesley et al., 2004). Nowe platformy szczepionkowe z całą pewnością będą dalej wykorzystywane w jako alternatywa dla szczepionek zabitych.
 Cały inaktywowany wirus |
 Wektorowa |
 Szczepionki z żywym atenuowanym wirusem |
|
| Droga podania | Domięśnieowo | Domięśniowo/ donosowo | Donosowo |
| Odpowiedź HI | +++ | ++ | + |
| Komórki wydzielające Ab | ++ | + | + |
| Limfocyty B | + | + | + |
| Nosowe IgA | -/+ | -/+ | +++ |
| Ab NA | +++ | -/+ | ++ |
| Limfocyty CD4 T | ++ | ++ | +++ |
| Limfocyty CD8 T | - | + | + |
| Odporność krzyżowa | -/+ | + | ++ |
| związane ze szczepionką zaostrzenie choroby układu oddechowego (VAERD) | Tak | -/+ | Nie |
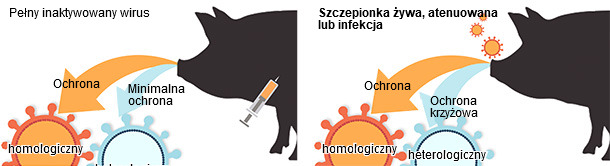
Ryc 2. Porównanie skuteczności szczepionek u świń (w oparciu o Sridhar et al., 2015).
Strategie szczepień powinny być zawsze planowane indywidualnie w kontekście określonej fermy. Szczepionki inaktywowane mogą być skuteczne jeśli są stosowane w połączeniu z innymi praktykami, takimi jak regulacja przepływu zwierząt i ludzi, i biorąc pod uwagę czy dana szczepionka jest antygenowo dopasowana do lokalnie występującego szczepu. Wiedza na temat krążących na fermie szczepów jest niezbędna. Grypa u świń jest chorobą dynamiczną, która stale ewoluuje, a więc monitoring i strategia zwalczania musi być dokładna i stale dopasowywana do zmieniającej się sytuacji.



