Zmiany odpowiedzi immunologicznej w przewodzie pokarmowym związane ze stresem
Między organizmem zwierzęcia a otaczającym go ekosystemem musi być zachowana równowaga . Szczególnie ważne jest zapobieganie przewlekłym procesom zapalnym na ogromnej powierzchni błony śluzowej jelit (około 300 m2 u 100-kg tucznika).

Rycina 1. Błona śluzowa jelit 100-kg tucznika zajmuje około 300m2

Tkanka limfatyczna przewodu pokarmowego (ang. gut-associated lymphoid tissue, GALT) znajdująca się tuż pod nabłonkiem przewodu pokarmowego jest największym bastionem układu odpornościowego. Funkcją komórek odpornościowych wchodzących w skład GALT jest szybka i silna reakcja na inwazję mikroorganizmów lub ich toksyn oraz ograniczenie zakresu reakcji wobec czynników niepatogennych, aby zapobiec nadmiernej aktywności układu odpornościowego, a w konsekwencji nadmiernemu uszkodzeniu organizmu przez reakcję zapalną (Burkey i in., 2009).

Rycina 2. Wśród GALT możemy wyróżnić kilka zasadniczych populacji: limfocyty odpowiedzi nieswoistej (ILL) znajdują się w jelicie cienkim i w mniejszym stopniu w jelicie grubym, odgrywają ważną rolę jako producenci cytokin, cząsteczek cytotoksycznych i peptydów przeciwdrobnoustrojowych (Hepworth i in., 2013; Schäfer i in., 2019; Wiarda i in., 2020; Wiarda i in., 2021; Xiao i in., 2019).
Odpowiedź immunologiczna jest uruchamiana, gdy komórki układu odpornościowego rozpoznają patogen, co powoduje szybkie uwalnianie cytokin prozapalnych, TGF beta i innych mediatorów do otaczających tkanek i krwiobiegu. Cytokiny przekazują komórkom efektorowym informacje o miejscu zakażenia, a te ostatnie pomagają w usunięciu patogenu.
Stres związany ze środowiskiem życia zwierzęcia upośledza barierę jelitową i wywołuje immunosupresję jelitowych odpowiedzi immunologicznych w wyniku regulacji w górę IL-10 (Li i in., 2017), co może obniżyć wydajność produkcji i zwiększyć częstość występowania chorób (Peng i in., 2021).
Stres immunologiczny i jego wpływ na organizm i produkcję
Stres immunologiczny definiowany jest jako długotrwała mobilizacja immunologiczna organizmu zwierzęcia, związana z obroną przed stałą presją niekorzystnych warunków środowiskowych, w tym patogenów. Nadal nie ma pełnego zrozumienia mechanizmów związanych z długotrwałym stresem immunologicznym, które decydują o negatywnym wpływie na rozwój zwierzęcia, w tym o wyższej zachorowalności i śmiertelności, zwiększonym współczynniku konwersji paszy (FCR) oraz zróżnicowaniu masy ciała pomiędzy świniami w tym samym wieku. Wiadomo jednak, że nieswoisty układ odpornościowy jest częścią pierwszej linii obrony przeciwinfekcyjnej gospodarza. Bariery nabłonka i błony śluzowej stanowią pierwszą barierę dla czynnika patogennego.
Gdy patogen jest silnie zjadliwy lub występuje w dużej liczbie, albo gdy bariery są uszkodzone, możliwe jest przełamanie ich i zainfekowanie gospodarza. Mikroorganizmy, które przełamały takie bariery, są rozpoznawane przez komórki układu odpornościowego za pośrednictwem wzorców molekularnych związanych z patogenami (PAMP) pochodzących od bakterii, wirusów, grzybów i pierwotniaków przez receptory Toll-like (TLRs). TLR, ulegające ekspresji na makrofagach, komórkach dendrytycznych, komórkach tucznych i NK, a także na limfocytach T i B, odróżniają patogeny od elementów martwych i nieaktywnych (debris) (Mair i in., 2014). Aktywacja TLR jest kluczowym sygnałem do uruchomienia zarówno nieswoistej, jak i swiostej odpowiedzi immunologicznej oraz do zwalczania patogenu przy udziale masywnej proliferacji komórek odpornościowych i produkcji immunoglobin, cytokin, chemokin, białek ostrej fazy i wielu innych.
Podczas stresu immunologicznego priorytetem metabolicznym jest głównie produkcja APP przez wątrobę. Do białek ostrej fazy należą białka, których stężenie w osoczu wzrasta o co najmniej 20% po uszkodzeniu tkanek. Priorytetowym działaniem APP jest przywrócenie homeostazy organizmu. Negatywną konsekwencją aktywności APP jest zwiększony katabolizm prowadzący do utraty masy ciała. Jest to związane z utrzymującym się wysokim poziomem cytokin wydzielanych przez pobudzone leukocyty. Utrata masy ciała jest nasilona przez nadprodukcję cytokin, które przyczyniają się do zmian nastroju i zachowania prowadząc do osłabienia, a czasem nawet braku apetytu (Dantzer i in., 2008; Chaytor i in., 2011; McKim i in., 2018; Munshi i in., 2019).
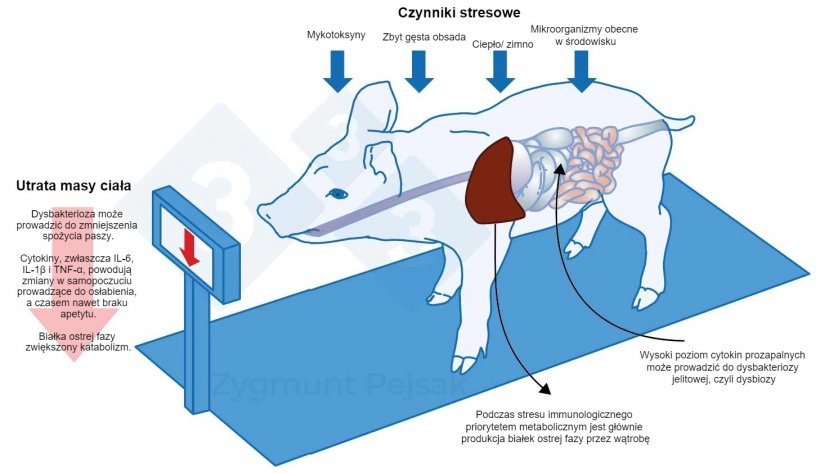
Ryc. 3. Dodatkowym kosztem długotrwałego alertu jest pogorszenie apetytu, a w konsekwencji wydłużenie okresu tuczu. Ponieważ presja stresorów środowiskowych w różny sposób oddziałuje na poszczególne zwierzęta, wystąpi zróżnicowanie masy ciała prosiąt odsadzonych lub tuczników w tym samym wieku. Zróżnicowanie wagi wśród zwierząt w tym samym wieku może mieć poważne konsekwencje ekonomiczne. Również, zwłaszcza u młodych zwierząt, dieta, która nie zawiera składników odżywczych niezbędnych do wzmocnienia odporności przeciwzakaźnej, może sprawić, że zwierzęta będą bardziej podatne na zakażenia.
Wszelkie zaburzenia homeostazy spowodowane wpływem długotrwałego stresu na organizm osłabiają jego obronę immunologiczną i zwiększają wrażliwość na mikroorganizmy chorobotwórcze. Nieprawidłowe żywienie zwierząt również może pogłębiać skutki zachwiania równowagi. Szczególnie u młodych zwierząt dieta, która nie zawiera składników odżywczych niezbędnych do wzmocnienia odporności przeciwzakaźnej, może sprawić, że zwierzęta będą bardziej podatne na zakażenia mikroorganizmami chorobotwórczymi. Odpowiednia dieta może wspierać układ odpornościowy świni, a u loch może nawet pozytywnie wpływać na układ odpornościowy jej prosiąt (Werner i in., 2014; Rudar i in., 2016). Z drugiej strony, mykotoksyny naturalnie obecne w kukurydzy mogą powodować zmienioną odpowiedź immunologiczną z ogólnoustrojowym stanem zapalnym i częściowym uszkodzeniem wątroby, powodując zmniejszenie wzrostu świń (Chaytor i in., 2011).
Nadmierny, długotrwały alert immunologiczny prowadzi do zmian zapalnych w jelitach, a wysoki poziom cytokin prozapalnych może prowadzić do dysbakteriozy jelitowej, czyli dysbiozy (zaburzenia równowagi mikrobiologicznej w jelitach). Może to powodować niepożądane konsekwencje wpływające na cały organizm (Dobson i in., 2000). Zmiany w składzie mikrobiomu mogą być jakościowe, takie jak zmniejszenie różnorodności flory jelitowej, i/lub ilościowe, takie jak zmiany w liczbie poszczególnych bakterii.
Inną konsekwencją długotrwałego alertu immunologicznego może być okresowe pogorszenie apetytu, a w konsekwencji wydłużenie okresu tuczu. Często obserwuje się pogorszenie wskaźnika FCR. Ponieważ presja stresorów środowiskowych w różny sposób oddziałuje na poszczególne zwierzęta, wystąpi zróżnicowanie masy ciała odsadzonych lub tuczonych świń w tym samym wieku, co może mieć poważne konsekwencje ekonomiczne.
Podsumowując, minimalizacja ekspozycji świń na stres, ograniczenie przeżywalności i namnażania się mikroorganizmów patogennych i warunkowo patogennych, a także poprawa zarządzania, mogą znacząco poprawić funkcjonowanie układu odpornościowego świń, a w konsekwencji obniżyć koszty produkcji poprzez poprawę wykorzystania paszy i zmniejszenie kosztów leczenia.




