Zaburzenia rozrodcze wywołane przez wirus zespołu rozrodczo oddechowego świń (PRRSV) charakteryzują się śmiercią zarodków, późnymi ronieniami, przedwczesnymi porodami i zwiększeniem liczby martwo urodzonych i słabych prosiąt. Ostatnie odkrycia wskazują, że endometrium i łożysko odgrywają rolę w transmisji zakażenia PRRSV od lochy na płody, i że przyczyną śmierci płodów może być replikacja wirusa w tkankach endometrium i łożyska. Lepsze zrozumienie tych zjawisk może ułatwić opracowanie skuteczniejszych metod zapobiegania chorobie.
Najprawdopodobniej transmisję PRRSV z organizmu lochy na płody umożliwia obecność komórek wrażliwych na infekcję tym wirusem w endometrium i łożysku. Zgodnie z tą hipotezą, najwyższa liczba komórek CD163+ i Sn+ (komórki wrażliwe na zakażenie PRRSV) pojawia się w endometrium i łożysku w 90-110 dniu ciąży. Duża liczba tych komórek w tym okresie może po części wyjaśniać fakt, że do wrodzonych zakażeń PRRSV dochodzi niemal wyłącznie w końcowej fazie ciąży. Wcześniejsze doświadczenia wykazały, że również środowisko endometrium może odgrywać rolę w pojawianiu się infekcji łożyska, i transmisji przez łożysko. Stwierdzono, że u lochy zakażonej PRRSV w 70 dniu ciąży, w 80 dniu ciąży nie stwierdzono infekcji komórek łożyska, mimo że obecne w nim były komórki CD163+ i Sn+, i mimo, że we krwi lochy krążył wirus. Z kolei w przypadku loch zakażonych PRRSV w 90 dniu ciąży, w 100 dniu ciąży w endometrium i łożysku stwierdzono już intensywną replikację wirus. Podsumowując, dotychczas nie odkryto czynników blokujących lub hamujących replikację PRRSV w endometrium. Być może takie czynniki, oraz niedostateczna liczba wrażliwych na zakażenie komórek w łożysku, działają synergistycznie wywołując odporność na śródmaciczne zakażenie płodów przed 90 dniem ciąży.

Ostatnie wyniki badań wykazały obecność komórek zakażonych PRRSV i ulegających apoptozie (programowana śmierć komórki) zlokalizowanych w endometrium i łożysku trzech loch zakażonych w 90 dniu ciąży i poddanych eutanazji 10 dni później. W 10 dni po zakażeniu lochy posiadały PRRSV we krwi a wirus zakaził wszystkie płody. U zakażonych loch replikację PRRSV stwierdzono metodą immunofluorescencji w endometrium i łożysku. Liczba komórek zakażonych PRRSV w łożysku (1-289/10 mm2 tkanki) była istotnie wyższa niż w endometrium (1-16/10 mm2 tkanki; p = 0.004). Liczba komórek wykazujących oznaki apoptozy była istotnie wyższa w endometrium loch zakażonych PRRSV niż loch kontrolnych (niezakażonych) (Ryc. 1). Ilość komórek apoptotycznych była znacznie wyższa w łożyskach zakażonych PRRSV niż w łożyskach niezakażonych. Główny wniosek płynący z wyników tych badań mówi, że PRRSV ulega replikacji w endometrium i łożysku i powoduję apoptozę komórek w późnej fazie ciąży. Już w 20 dniu po infekcji, w tkankach zakażonych PRRSV stwierdza się silne zmiany mikroskopowe, od miejscowej separacji nabłonka macicy i trofoblastu, do całkowitej degradacji płodowej mezenchymy w łożysku (Fig. 2). Ponieważ integralność między matczyną i płodową częścią łożyska jest kluczowa dla wymiany gazowej (O2/CO2), odżywiania i usuwania szkodliwych produktów przemiany materii płodów, zmiany te utrudniają podtrzymanie funkcji życiowych płodu.
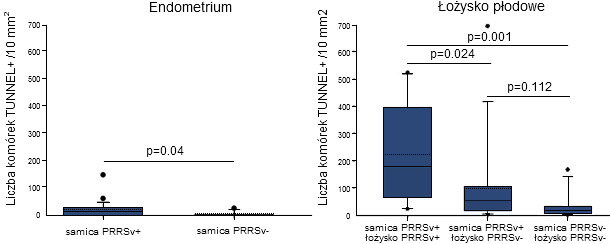
Ryc. 1. Oznaczenie ilościowe komórek ulegających apoptozie w endometrium i łożysku pobranych od samic zakażonych PRRSV w 90 dniu ciąży i samic wolnych od zakażenia
Próbki pobrano w 100 dniu ciąży. Ciągłe i przerywane linie oznaczają odpowiednio medianę i średnią. Każde pudełko ukazuje 25-75% obserwacji. Wąsy poniżej i powyżej pudełka reprezentują 10-ty i 90-ty percentyl. Kropki poniżej i powyżej zakończeń wąsów pudełek oznaczają obserwacje odstające (nie pasujące do modelu), nie mieszczące się w przedziale między 10 i 90% obserwacji. Różnice uznawano za statystycznie istotne dla p≤0.05. (Karniychuk et al., 2011).
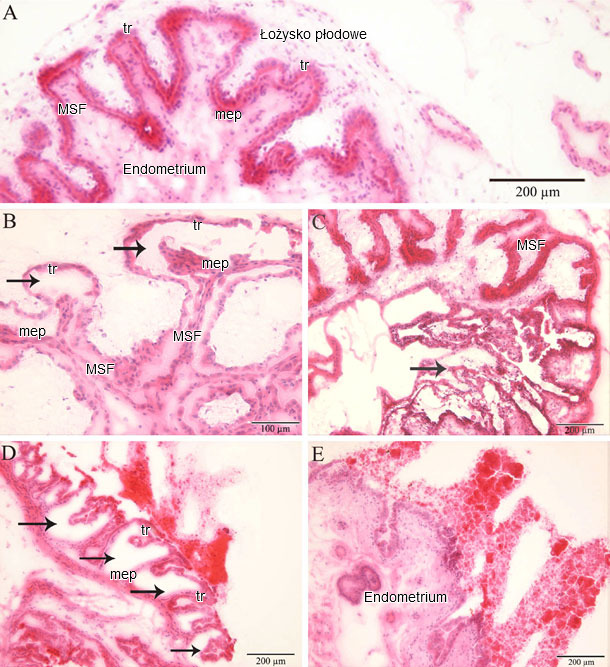
Fig. 2. Obraz mikroskopowy endometrium i łożyska
(A) Miejsca implantacji przy braku zakażenia PRRSV, bez zmian mikroskopowych (MSF: łożysko matczyne; mep: nabłonek macicy; tr: trfoblast). Miejsca implantacji ze zmianami mikroskopowymi przy zakażeniu PRRSV: (B) ogniskowe odklejanie się trofoblastu od nabłonka macicy; (C) ogniskowe zwyrodnienie łożyska płodowego;(D) wieloogniskowe zwyrodnienie łożyska płodowego; i (E) całkowite zwyrodnienie łożyska płodowego (Karniychuk et al., 2012).
Obecnie szczepienie jest uważane za podstawową metodę zwalczania zakażeń PRRSV. Niedawno przeprowadzono badania z wykorzystaniem eksperymentalnej szczepionki inaktywowanej przeciw PRRS, wyprodukowanej przy pomocy nowej procedury inaktywacji i zastosowaniu odpowiedniego adjuwantu. Wyniki pokazały, że nowa szczepionka inaktywowana jest w stanie indukować przeciwciała neutralizujące i lekko ograniczyć czas trwania wiremii u loszek. Wykazano również, że doszło do zmniejszenia liczby płodów zakażonych PRRSV i poprawy ich żywotności. Te korzystne efekty zostały najprawdopodobniej osiągnięte dzięki ograniczeniu transmisji wirusa z endometrium (pierwotne miejsce replikacji PRRSV przed zakażeniem płodów) na łożysko, ponieważ liczba komórek zakażonych PRRSV w łożysku była istotnie wyższa w przypadku nieszczepionych loszek niż u szczepionych. Taka szczepionka może być rekomendowana w fermach zakażonych endemicznie, samodzielnie lub w połączeniu z innymi szczepionkami, w celu ograniczenia strat na skutek zakażenia PRRSV u ciężarnych loch. Celem jest indukcja przeciwciał neutralizujących przed 80-tym dniem ciąży, kiedy lochy stają się wrażliwe na zakażenie łożyska i transmisję infekcji na płody. Szczepienie loszek żywą szczepionką przed inseminacją lub na początku ciąży, a następnie szczepienie nową szczepionką inaktywowaną może stworzyć nowe możliwości w walce z zaburzeniami rozrodczymi wywołanymi zakażeniem PRRSV.