Pojawienie się nowych szczepów wirusa PRRS wraz z ograniczeniami w stosowaniu antybiotyków zmienia paradygmaty w produkcji świń. W całej Hiszpanii faktem jest, że śmiertelność świń od odsadzenia do sprzedaży do ubojni wzrosła o 4% z powodu wzrostu problemów zdrowotnych. Każdego dnia dowiadujemy się o nowych narzędziach do monitorowania wielu problemów zdrowotnych, które dotykają nasze gospodarstwa, ale musimy przyjąć inne podejście do zwykłych problemów i na tym polega praca lekarza weterynarii ds. produkcji: na wiedzy, jak się zmienić. Aby to zrobić, musimy polegać na aktualnej wiedzy opartej o badania (książki, artykuły naukowe, itp.), jak również na samych zwierzętach.
Obecnie jest dobrze udokumentowane, że mikrobiota jelitowa wyraźnie wpływa na modulację odpowiedzi zapalnych i dlatego każde zaburzenie trawienne, które prowadzi do zmian w mikrobiocie, prawdopodobnie powoduje zmniejszenie liczby makrofagów pęcherzykowych i zmianę odpowiedzi immunologicznej Th1 i Th2 ( limfocyty T pomocnicze). W konsekwencji może dojść do nasilenia odpowiedzi zapalnej na poziomie płucnym, a także do wzrostu nawrotów i utrzymywania się chorób płuc.

Przypadek kliniczny
Mamy do czynienia z farmą liczącą około 2000 loch hodowlanych, zlokalizowaną w hiszpańskim regionie Murcia. Teren ma powierzchnię około 100 hektarów, więc poszczególne etapy produkcji znajdują się w znacznej odległości od siebie. Lochy hodowlane znajdują się w jednym miejscu, odchowalnie są oddalone o 1 km, a tuczarnie są rozmieszczone w odległości około 3 km od loch hodowlanych.
Ferma loch hodowlanych jest PRRSv dodatnia i obecnie jest stabilna. Posiada miesięczny plan monitorowania, który obejmuje pobieranie języków od martwo urodzonych prosiąt, różnicując prosięta od loch wieloródek i pierworódek. Monitorowanie to polega na przeprowadzaniu testów PCR na obecność PRRS i PCV-2, co ma na celu zwalczanie obu wirusów w gospodarstwie. W tym okresie analizy języków były ujemne dla PRRS i PCV-2. Kiedy próbka jest dodatnia dla wirusa PRRS, wykonujemy sekwencjonowanie fragmentu genomu ORF5, aby sprawdzić, czy jest to nowy szczep pochodzący z nowego wprowadzenia wirusa, co wskazywałoby na błędy w zewnętrznym bezpieczeństwie biologicznym.
Ferma jest dodatnia pod kątem obecności Brachyspira hyodysenteriae, ale dzięki zastosowaniu szczepionek autogennych objawy kliniczne są kontrolowane i nie obserwuje się ich u loch produkcyjnych ani u loszek remontowych, które mają wspomnianą szczepionkę autogenną włączoną do programu szczepień. Choroba kliniczna jest uznawana za opanowaną, chociaż czasami w tuczarniach pojawiają się objawy wskazujące na dyzenterię świń, gdy świnie ważą około 50-80 kg, co zbiega się z utratą odporności nabytej od matki.
Na tuczarniach obserwuje się problem związany z gryzieniem ogonów, co uważamy za wskaźnik obecności dyzenterii, nawet w przypadkach, gdy nie obserwujemy wyraźnie obrazu klinicznego choroby. Jeśli świnie mają subkliniczną chorobę, a więc stan zapalny w jelicie grubym, mają tendencję do większej nerwowości i uporczywego poruszania ogonem. Jak wiadomo, działa to jak magnes dla innych świń z kojca, które zaczną się wzajemnie gryźć. Nieprawidłowe zachowanie, które pojawiło się choć raz jest trudne do opanowania. Przewlekły stan zapalny wywołuje zachowania lękowe.

Fot. 1. Świnie z pogryzionymi ogonami
Początek problemu
Zwierzęta są przenoszone do tuczarni przeznaczonych dla 6 000 zwierząt, które tam przebywają przez cztery kolejne tygodnie. Po miesiącu od wprowadzenia zwierząt rozpoczynają się oddechowe objawy kliniczne z silną dusznością i niechęcią do pobierania paszy. Podjęta zostaje decyzja o zastosowaniu leczenia antybiotykowego z rozpuszczalnym florfenikolem w wodzie pitnej (w połączeniu z lekiem przeciwzapalnym w pierwszym dniu, aby zwiększyć spożycie wody), ale po zastosowaniu leczenia nadal występuje podwyższona śmiertelność i nie ma poprawy stanu zdrowia u zwierząt. Płuca od martwych zwierząt posiadają zmiany związane z obecnością rozległych obszarów o tęgiej konsystencji i zostają wysłane do laboratorium. Podjęto decyzję o podaniu iniekcyjnej kuracji antybiotykowej (marbofloksacyna) wszystkim świniom, Chodziło z jednej strony o zapewnienie, że każde zwierzę otrzymało odpowiednią dawkę, a z drugiej o dotarcie do płuc skutecznego stężenia antybiotyku. Pomimo poprawy ogólnego stanu zwierząt, po dwóch tygodniach obserwuje się nawrót choroby i nadal nie jesteśmy w stanie kontrolować występujących strat. Obraz kliniczny powraca z takim samym nasileniem i nadal jest przyczyną wielu upadków (fot. 2 i 3).
Fot. 2. Świnie z widocznym zasinieniem skóry Fot. 3. Świnie z gorączką

Wszystkie próbki były ujemne dla PCV-2 i grypy typu A, a dodatnie dla wirusa PRRS, więc przystąpiliśmy do sekwencjonowania wirusa w regionie ORF5, aby sprawdzić, czy do gospodarstwa dostał się szczep o wysokiej zjadliwości, który mógłby wyjaśnić nasilenie objawów klinicznych.
Tabela 1.Analiza próbek płuc i płynu ustnego, które zostały pobrane w tuczarni
| Data | Tuczarnia | Próbka | PRRSv | PCV-2 | Grypa typu A |
|---|---|---|---|---|---|
| XI 22 | A | Płuco | PRRSv (Ct 28) | - | - |
| XI 22 | B | Płuco | PRSSv (Ct 20) | - | - |
| XI 22 | C | Płyn ustny | PRRSv (Ct 30) | - | - |
| XI 22 | D | Płyn ustny | PRRSv (Ct 36) | - | - |
Pojawiła się jednak istotna obawa: zwykle nowo wprowadzony patogen, jeśli ma niską częstość występowania, daje objawy kliniczne pod koniec tuczu i wraz ze wzrostem jego częstości występowania objawy pojawiają się u coraz młodszych zwierząt. W tym przypadku tak się jednak nie stało, więc sądziliśmy, że leczenie antybiotykami zmniejszy wpływ choroby, ale tak się nie stało.
Kiedy uzyskano sekwencje wirusa PRRS, okazało się, że jest to ten sam szczep, ponieważ istniała homologia filogenetyczna ze szczepem od dawna obecnym w systemie produkcyjnym. Jednakże nigdy dawał on takich objawów na tuczu. Wcześniej pojawiały się symptomatologiczne objawy oddechowe, ale były one z powodzeniem kontrolowane za pomocą antybiotykoterapii (florfenikol).
Co działo się ze świniami na etapie tuczu, co może wyjaśnić ten nietypowy przebieg choroby?
W tej chwili proponuje się nowy sposób podejścia do zakażenia, ponieważ jest coraz większa wiedza na temat osi jelito-płuca i uznaje się, że to, co dzieje się w jelicie, wpływa na nasilenie choroby układu oddechowego.
Zastanawialiśmy się, czy istnieje jakieś inne zaburzenie stanu zdrowia zwierząt nie dotyczące płuc, ale raczej jelitowe. Wyizolowaliśmy Brachyspira hyodesenteriae w kale. Odnotowanie tego patogenu na fermie nie było nowością, ale myśleliśmy, że choroba wywoływana przez B. hyodysenteriae jest kontrolowana, ponieważ nie występowały klasyczne objawy biegunki, a jedynie miękki, luźny kał, który nie wydawał się mieć większego znaczenia klinicznego.
Czy obecność Brachyspira hyodesenteriae może być jedną z przyczyn nasilenia i utrzymywania się objawów klinicznych?
HIPOTEZA: "Obecność Brachyspira hyodesenteriae i jej wpływ na mikrobiotę jelitową może wpływać na modulację odpowiedzi zapalnych ze wzrostem odpowiedzi zapalnej na poziomie płucnym, powodując również redukcję liczby makrofagów płucnych, a zatem tworząc środowisko immunologiczne, w którym nie było możliwe wyeliminowanie wirusa PRRS z wystarczającą skutecznością, a także prowadząc do wzrostu liczby nawrotów i utrzymywania się chorób płucnych."
Przystąpiliśmy do sprawdzenia, czy wyizolowany szczep Brachyspira hyodesenteriae jest tym samym szczepem będącym od dawna na fermie oraz do określenia MIC dla różnych antybiotyków, które musieliśmy zastosować do jego zwalczania.
Tabela 2. MIC poszczególnych antybiotyków dla wyizolowanego szczepu Brachyspira hyodesenteriae.
| Szczep SV22-3448 | |||||
|---|---|---|---|---|---|
| Badane antybiotyki (μg/ml) |
MIC (μg/ml) |
Interpretacja | Zakres (μg/ml) | ||
| Tiamulina (0.063 - 8) | 0.5 | Średnio wrażl. |
≤ 0.25 > 0.25 - ≤ 2 > 2 |
Wrażliwe Śred. wrażl. Oporne |
La et al., 2016 |
| Walnemulina (0.031 - 4) | < 0.031 | Wrażliwe |
≤ 0.25 > 0.25 - ≤ 2 > 2 |
Wrażliwe Śred. wrażl. Oporne |
La et al., 2016 |
| Tylwalozyna (0.25 - 32) | 8 | Średnio wrażl. |
≤ 0.25 - < 1.5 > 1.5 - ≤ 36 > 36 |
Wrażliwe Śred. wrażl. Oporne |
Pringle et al., 2012 |
| Linkomycyna (0.5 - 64) | 32 | Średnio wrażl. |
≤ 4 > 4 - ≤ 36 > 36 |
Wrażliwe Śred. wrażl. Oporne |
Kirchgässner et al., 2016 |
| Tylozyna (2 - 128) | > 128 | Oporne |
≤ 1 > 1 - ≤ 4 > 4 |
Wrażliwe Śred. wrażl. Oporne |
La et al., 2016 |
Jak widzimy w Tabeli 2, tiamulina wydawała się najlepszą opcją, ale na poziomie gospodarstwa, biorąc pod uwagę fizyczne cechy wody w regionie Murcji (niska jakość i wysokie zasolenie), antybiotyk ten nie zapewnia dobrej skuteczności, czyniąc linkomycynę aktywnym składnikiem, który może skuteczniej rozwiązać problem kliniczny. Przystąpiliśmy do stworzenia antybiotykoterapii ukierunkowanej przede wszystkim na kontrolę dyzenterii świń na poziomie subklinicznym.
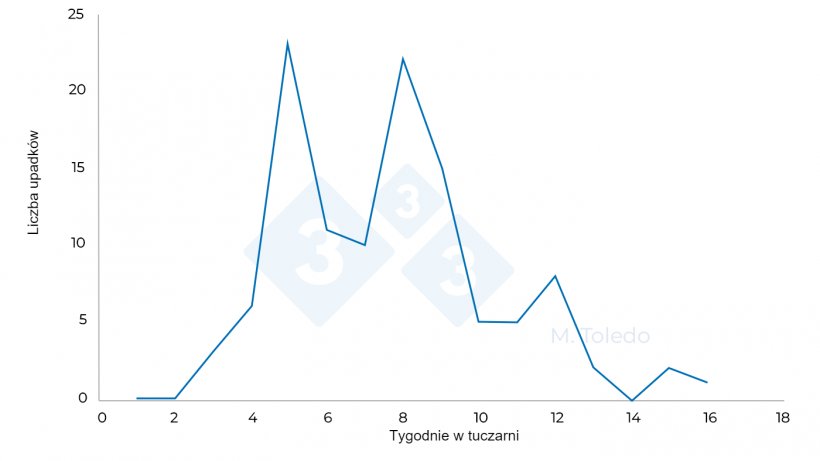
Wykres 3. Zmiany liczby upadków na tuczu po podaniu leków: S4 - florfenikol w wodzie pitnej, S6 - marbofloksacyna w iniekcji, S8 - tiamulina lub linkomycyna w wodzie pitnej.
Wniosek
Skutecznym podejściem do tego przypadku klinicznego było opanowanie dyzenterii, nawet jeśli stwierdziliśmy ją podklinicznie. W ten sposób choroba układu oddechowego rozwijała się w sposób znacznie mniej agresywny i bez nawrotów. Kontrolowanie dyzenterii doprowadziło również do ograniczenia występowania nowych epizodów gryzienia ogonów.
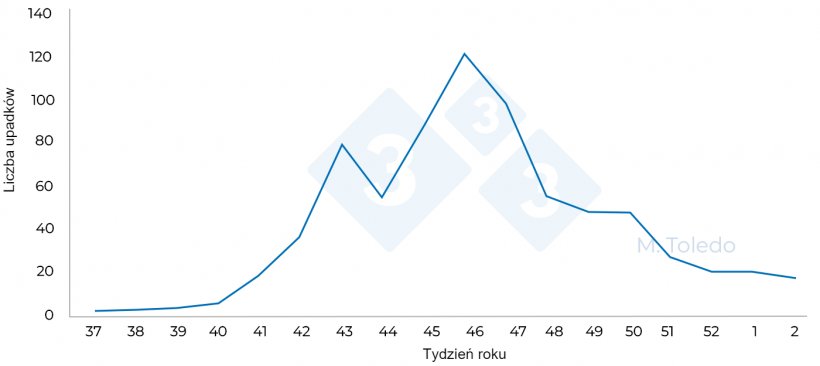
Wykres 4. Całkowita liczba zgonów świń na etapie tuczu w tygodniach w roku
Musimy zacząć inaczej podchodzić do chorób układu oddechowego (zwłaszcza do tej, która sprawia nam najwięcej problemów, czyli wirusa PRRS), poprzez monitorowanie i kontrolowanie zaburzeń jelitowych, które pojawiają się w wyniku interakcji pomiędzy różnymi patogenami jelitowymi, które są w stanie wywołać dysbiozę. Ważne jest, aby nie rozpatrywać tych patogenów układu pokarmowego indywidualnie, ponieważ istnieje wiele interakcji między nimi (Brachyspira spp, Lawsonia intracellularis, Escherichia coli, itp.). Ta zmiana w systemie jelitowym może modulować intensywność i czas trwania chorób układu oddechowego, a tym samym komplikować ich kontrolę.